[拼音]:reliang
[外文]:heat
热力学系统同外界或系统各部分间存在温度差发生传热时所传递的能量。
热质说在历史上占统治地位时,人们曾错误地把热量当作是传递着的“热质”(见热的本质)。热力学第一定律建立以后,揭示了热量是由于热接触引起的热力学系统能量的变化量,此量同传热的过程有关,故热量不是系统状态的函数,它仅在系统状态发生变化时才有意义。
热量和功相当,二者都是传递着的能量,其区别在于作功同系统在广义力作用下产生的广义位移相联系,即同系统各部分的宏观运动相联系;而传热是基于系统同外界温度不一致而传递的能量,是和物质的微观运动相联系的。
热量的数值可通过热容及温度的变化而求得。对于一个微小变化的过程:
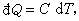
婾Q为被传递的热量,C为某一过程的热容,dT为系统温度的变化。对一个有限过程,则
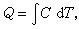
积分在给定过程的条件下进行。
热量的单位与能量和功的单位相同,都是焦耳;其非国际制单位是卡。