[拼音]:Paoli yuanli
[外文]:Pauli principle
在一个原子中,最多只能有两个电子处于由n、l、m规定的同一状态(习惯上叫轨道),但这两个电子的自旋方向必然相反;或者说在一个原子中不可能有两个或更多个电子具有完全相同的四个量子数。一组n、l、m、ms为一个量子态,每个量子态只能容纳一个电子。
在给定n、l时,因m=0,±1,±2,…,±l,共有(2l+1)个状态,在每一种状态中的ms=+1/2或-1/2,因此在给定n、l时,共有2(2l+1)个m和 ms不全同的量子态, 即只能容纳2(2l+1)个电子。l=0的状态即s状态,只能容纳2个电子;l=1的状态,即P状态可容纳6个电子;l=2时是d状态,可容纳10个电子;l=3的 f 状态,可容纳14个电子。总之,从泡利原理可以知道:原子中具有相同主量子数n的电子数目为2n2:
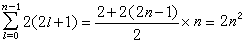
n=1的第一能级最多只能容纳2个电子;n=2的第二能级最多能容纳8个电子;……。在不违背泡利原理前提下,电子按能量最低原理逐个填入轨道。
碳原子有6个电子,前4个电子的构型和铍原子(见图)
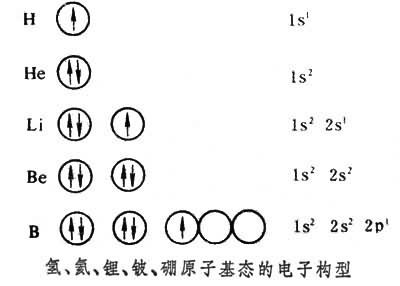
相同,最后两个电子排在p轨道上,而2p有三个轨道,按照洪德规则(见电子构型)两个电子排在两个轨道上。