[拼音]:duosuan
[外文]:polyacid
两个或两个以上的含氧酸分子缩合去水(见缩合反应)而成的酸。例如,两个磷酸H3PO4分子去水缩合而成的焦磷酸H4P2O7,就是一种双酸:
2H3PO4─→H4P2O7+H2O
多酸中含有相同酸根的称为同多酸,含有不同酸根的称为杂多酸;相应的盐称为同多酸盐和杂多酸盐。同多酸及其盐如重铬酸 H2Cr2O7和重铬酸钾K2Cr2O7;杂多酸及其盐如十二水合十二钼磷酸H3[PMo12O40]·12H2O和十二钼磷酸钾K3[PMo12O40]。
多酸是一种多核配合物(见配位化合物)。化学元素中有近40种元素可形成多酸,包括各个成酸元素、两性元素以至若干金属性较强的元素。元素周期表(见彩图)
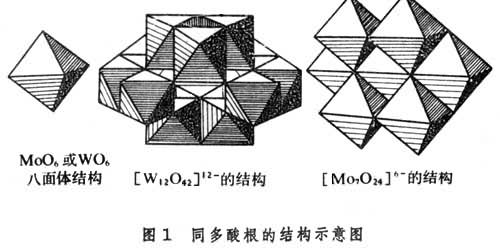
中尤以第ⅤB和第ⅥB族元素能形成同多酸根离子。大部分含氧酸可以形成多酸;有些含氧酸,例如硝酸HNO3和碳酸H2CO 不能缩合生成同多酸。多酸的结构问题尚未彻底解决。现在认为:钒酸根、钼酸根和钨酸根离子生成同多酸根离子是通过共有MO6(M表示V、Mo、W)八面体的顶点或棱边相联结,共面相联结的情况极少(图1)。
不能缩合生成同多酸。多酸的结构问题尚未彻底解决。现在认为:钒酸根、钼酸根和钨酸根离子生成同多酸根离子是通过共有MO6(M表示V、Mo、W)八面体的顶点或棱边相联结,共面相联结的情况极少(图1)。
同多酸的聚合度类型有:
(1)有限而无定度缩合,如铬酸根离子,有Cr2O崻、Cr3O崠、Cr4O崘等;
(2)有限而有一定度缩合,如钼酸根和钨酸根离子,有六多酸、十二多酸等;
(3)无限而无定度缩合,如硅酸根和磷酸根离子。单硅酸可缩合为二、三、四、……至极高聚硅酸,成为硅酸溶胶或凝胶的粒子。
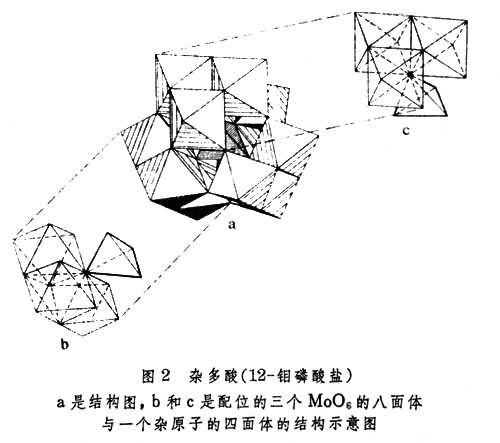
在杂多酸及其盐中,除碱金属和碱土金属外,几乎所有的金属元素都可作为中心原子(铬除外)。最早(1826年)报道的杂多酸根离子为PMo12O咮(图2)。杂多酸一般是强酸,比它的母酸要强得多。通常,含有较小阳离子的杂多酸盐可溶于水,含有较大阳离子的盐则难溶解。例如Na+盐可溶,Cs+、Pb2+和Ba2+的杂多酸盐不溶,NH嬃、K+和Rb+的杂多酸盐难溶。
简单酸根离子溶液酸化时,逐渐生成各种同多酸根离子,其复杂性随酸度增高而增大。例如钼酸根离子MoO娸仅存在于pH较高的溶液中,当pH降低至4~5时,发生质子化和去水作用,生成七钼酸根离子Mo7O愺-,在酸性更强的溶液中,生成八钼酸根离子Mo8O忲-。继续酸化,进一步聚合,以至沉淀出水合MoO3。杂多酸盐通常可由酸化各组分酸的盐溶液制得,例如酸化钼酸盐和钨酸盐溶液,形成钼和钨的杂多酸根离子:
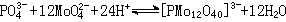
多酸盐可用于化学分析,如钼磷酸盐可用于比色测定(见比色法),(NH4)3[PMo12O40]的难溶性可用于磷酸盐的重量分析。多酸盐还可做催化剂,如钨磷酸盐可催化乙烯聚合。此外,钼磷酸铊可用作无机离子交换剂。
- 参考书目
- J.E.Huheey, Inorganic Chemistry, Principles ofStructure and Reactivity, 3rd ed., Harper and International Science, Cambridge, 1983.