[拼音]:zhangli xueshuo
[外文]:strain theory
关于分子中不正常的键角引起张力的学说。早期,A.von拜耳将碳原子的四面体理论用到环烷烃上,认为碳环为一平面,若键角偏离正常的碳四面体键角(109°28′)越大,则脂环的张力越大。由于五或六元环的键角与109°28′相近,所以最为稳定。拜耳的张力学说在有机化学发展史上起过一定的作用。但是拜耳还将这个学说沿用于六元或大于六元环的化合物,事实证明,这是错误的(见环己烷)。
一般来说,有两种分子结构可以产生不正常的键角:一是小环化合物,它们的轨道交叠要比正常的轨道交叠小,这样产生的张力称为小键角张力;另一种是分子中非键原子间,由于几何形状所限,被迫处于彼此靠近的距离,从而产生张力,这种张力称为非键合的相互作用。
三元环和四元环有很大的键角张力。三元环的键角为60°,离正常的109°28′偏差很大,同时环上的三对氢原子均处于重叠式位置,容易产生张力,因而很不稳定。与正常的sp3杂化轨道相比,三元环上碳原子的四个杂化轨道并不均等,两个成环轨道的s成分少一些,比较接近于p轨道, 而两个环外轨道比正常的sp3杂化轨道有更多的s成分。由于这个特点,环丙烷在某些方面与烯烃的行为类似,能与很多试剂作用,发生开环反应。
四元环的环内键角为90°,比三元环大一些,张力也就小一点。但是由于有四个张力键,同时环上有四对氢原子处于重叠式位置,因而四元环也不大稳定。光谱研究证明,环丁烷不是平面的,其中一个亚甲基是弯曲的,与其他三个碳原子构成的平面形成25°夹角,从而减少了重叠式氢原子之间的张力,所以环丁烷的开环反应不如环丙烷容易,需要较激烈的条件。
近年来合成一些有代表性的高张力多环化合物,例如下列立体形状的多环:
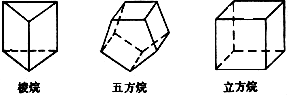
这些环烷被称为笼形化合物。这些高张力环烷的发现对有机结构理论和合成化学的研究都有重要的意义。