[拼音]:biegou xiaoying
[外文]:allosteric effect
某种不直接涉及蛋白质活性的物质,结合于蛋白质活性部位以外的其他部位(别构部位),引起蛋白质分子的构象变化,而导致蛋白质活性改变的现象。别构部位的概念是1963年由法国科学家J.莫诺等提出来的。影响蛋白质活性的物质称为别构配体或别构效应物。该物质作用于蛋白质的某些部位而发生的相互影响称为协同性。抑制蛋白质活力的现象称为负协同性,该物质称为负效应物。增加活力的现象称为正协同性,该物质称为正效应物。受别构效应调节的蛋白质称为别构蛋白质,如果是酶,则称为别构酶。
在50年代后期,先后发现某些氨基酸对催化其合成途径第一步反应的酶有抑制作用,这种现象称为反馈抑制。起抑制作用的物质与该酶的底物在结构上完全不同,这种结构不同于底物的抑制物是结合于酶的活性部位以外的其他部位,即别构部位而影响酶的活力的。图1以别构酶为例说明正负效应物是如何影响酶活力的。
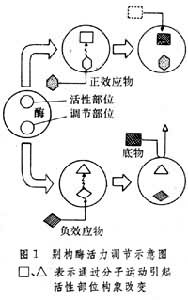
别构效应可分为同促效应和异促效应两类。相同配体(相同的结合部位)引起的反应称为同促效应,例如寡聚体酶或蛋白质(如血红蛋白)各亚基之间的协同作用即是同促效应。同促效应是同一种物质作用于不同亚基的相同部位而发生影响,因此是别构效应。不同配体(不同的结合部位)引起的反应称为异促效应,例如别构酶的别构结合部位和底物结合部位之间的反应即是异促效应。
1965年J.莫诺等提出,具有别构效应的体系应具有以下的通性:
(1)大部分别构蛋白质是含有几个亚单位的寡聚体或多聚体。
(2)别构效应常和蛋白质的四级结构变化有关(即亚基间键的变化)。
(3)异促效应可以是正的或负的,而同促效应总是正的协同作用。
(4)已经知道的仅具有异促效应的体系很少,但多数含有两个或多个配体的体系中,至少有一个配体具有协同性质的同促效应。
(5)任何能改变异促效应的条件,处理或突变也同时能改变同促效应。
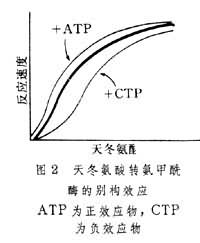
研究得较为清楚的别构酶是大肠杆菌的天冬氨酸转氨甲酰酶,简称ATC酶,催化下列反应:

这个反应是合成胞嘧啶核苷三磷酸(CTP)的第一步,它受终产物CTP反馈抑制,而被腺嘌呤核苷三磷酸(ATP)激活。酶反应速度与底物浓度的关系(图2)。图中曲线为S型,说明底物有正协同性。加入负效应物CTP,活力降低,S型更明显。加入正效应物,活力升高,S型趋势变小,接近双曲线。大多数别构酶均有这种S型曲线。
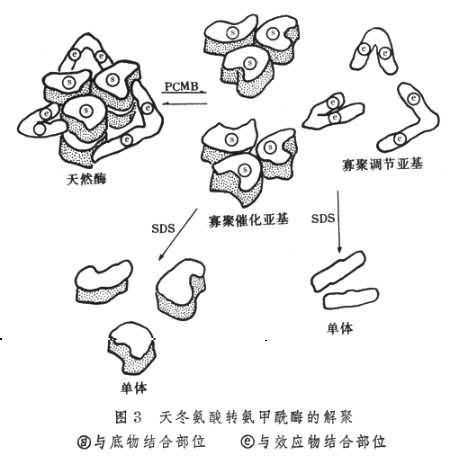
ATC 酶经过温和的化学处理,如用对羟基汞苯甲酸(PCMB)处理可解聚为两个催化亚基(为三聚体)和 3个调节亚基(为二聚体)。催化亚基仍有催化活力,但不再受效应物影响,调节亚基无催化活力,但仍能结合效应物。更剧烈的处理,如用十二烷基硫酸钠 (SDS)处理,则催化亚基和调节亚基都各解聚成6个单体(图3)。
ATC 酶受 CTP抑制的生物学意义是避免合成过多的CTP,而受ATP激活是为了保持嘌呤和嘧啶核苷酸合成的速度相称,以满足合成核酸的需要。别构酶在代谢调节中起着重要的作用。在合成代谢中催化第一步反应的酶或分支点的第一个酶往往是别构酶,以避免形成一系列过多的中间体和终产物。在分解代谢途径中,则有一个或几个关键酶为别构酶。如糖酵解途径中的磷酸果糖激酶是一个重要的调节酶,它受ATP抑制,而AMP可逆转ATP的抑制作用。故当ATP/AMP比值降低时,也就是细胞内能荷降低时,糖酵解被促进,从而提供较多的能量。
J.莫诺指出别构效应是通过蛋白质的构象变化而实现的。在当时对于酶的构象还缺乏详尽了解,而血红蛋白的精细的空间结构已由M.F.佩鲁茨阐明。血红蛋白是一个别构蛋白质,经过深入研究,现在已能用它的构象变化来阐明别构效应的机制。它的别构效应表现在:
(1)氧结合的正协同性,氧饱和曲线与氧分压的关系呈 S型曲线,表明在第 1个亚基与O2结合后其他亚基与O2的相继结合越来越容易,第4个亚基的氧结合常数可比第1个的大数百倍。这是因为第 1个亚基结合O2后引起血红蛋白分子的构象变化,促使其他亚基与O2结合。O2的释放过程也是如此,第1个O2释放使留下的O2更易释放。
(2)H+浓度升高(pH降低)使血红蛋白与O2的亲和力变小(玻尔效应),促进O2的释放。
(3)在恒定pH下CO2能降低血红蛋白与O2的亲和力。
(4)人红细胞中含有的2、3二磷酸甘油酸(DPG),也能降低O2的亲和力。
(5)血红蛋白与O2的结合也能抑制其与H+,CO2和DPG的结合。
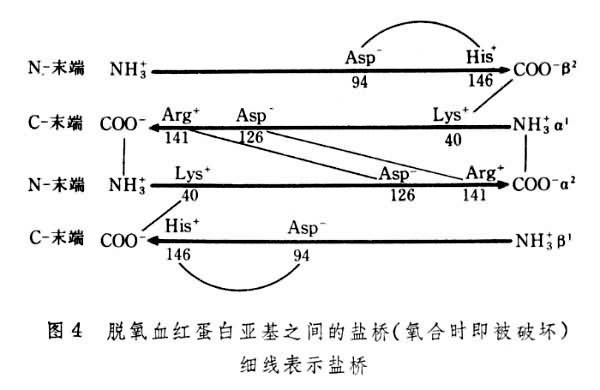
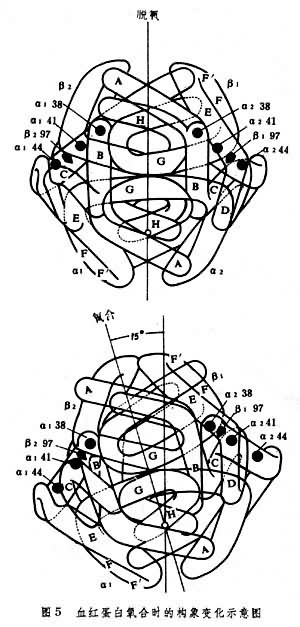
根据J.莫诺等提出的别构理论,别构酶处于两种构象状态,即紧张态(T态)和松弛态(R态),T态与底物的亲和力低,R态与底物的亲和力高。X射线衍射分析证明了脱氧血红蛋白Hb和氧合血红蛋白HbO2在构象上的差异。Hb4个亚基(α2β2)之间至少有8对盐桥相联系(图4),紧张态(T态)时O2的结合受到障碍,而在氧结合时这些盐桥被逐步破坏,生成的HbO2结构松散,属于R态,易与O2结合。这就是氧合时协同效应的基础。
血红蛋白氧合时构象变化的要点如下: 血红素中的铁与O2结合时随即进入卟啉环平面内,将邻近的原来倾斜的组氨酸F8拉直,并带动附近肽链的运动,结果导致αβ亚基相对于另一对αβ亚基转动15°角 (图 5)。如果将4个亚基标记为α1,α2,β1和β2,则 α1β1之间和 α2β2之间两个接触面较牢固,没有改变,变动最大的是 α1β2(或α2β1)之间的接触面,α1β2 (α2β1)界面的变动是T态向R态转变的开关 (反之亦然)(图6 )。在T态向R态转变时,盐桥破坏,当O2释放时,又通过该界面的滑动,盐桥重新恢复,R态又能转变成T态。α1β2(α2β1)界面的氨基酸序列是相当保守的,如在这一序列范围内发生突变则对别构效应有较大影响。

利用别构理论可以解释血红蛋白的一系列特殊的性质,例如波尔效应的分子机制是当H+浓度增高时,主要使β-亚基C-末端的β-146His侧链咪唑基(占波尔效应的40%),α亚基N-末端氨基(占25%),和α122His(占10%)以及其他组氨酸或赖氨酸的质子化,这样加强了盐桥,稳定了T态,O2不易结合。由于在Hb中β-146His受邻近的β-94ASP负电荷的影响更易质子化,而在HbO2中该His远离β-94ASP,质子化倾向降低。所以H+与Hb的亲和力要比与HbO2的亲和力更强。
CO2效应CO2与N-末端的缬氨酸的氨基发生氨甲酰化,形成负电荷,可以稳定T态。
 DPG效应
DPG效应
是由于它有5个负电荷(主要是4个),在Hb中位于两个β-亚基之间的空隙中,由β-亚基提供8个正电荷(N-末端,His2,Lys82和His143各两个)。有利于稳定T态。氧合之后,两个β-亚基距离减少(铁原子距离由39.9埃减到33.4埃)。而将DPG排挤出去。
别构效应在生命活动调节中起很重要作用。如阻遏蛋白受小分子物质的影响发生构象变化,改变了它与DNA结合的牢固程度,从而对遗传信息的表达进行调控。另如激素受体,神经递质受体等都是通过生物分子的影响发生构象变化而传递信息的。可以说别构效应是生物分子“通讯”的基础。