[拼音]:chendian didingfa
[外文]:precipitation titration
利用沉淀反应进行容量分析的方法。生成沉淀的反应很多,但符合容量分析条件的却很少,某些沉淀的组成不定,反应没有确定的计量关系;不少沉淀的溶解度较大,反应不完全;还有的反应速率低或存在副反应。实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-、SCN-和Ag+。银量法共分三种,分别以创立者的姓名来命名。
莫尔法
在含Cl-的中性或弱碱性试液中,加入指示剂铬酸钾,然后用硝酸银标准溶液滴定。由于氯化银的溶解度比铬酸银小,所以氯化银先沉淀,当砖红色的铬酸银沉淀生成时,表明Cl-已被定量沉淀,指示终点已经到达 (见彩图)。沉淀滴定的滴定曲线见图。



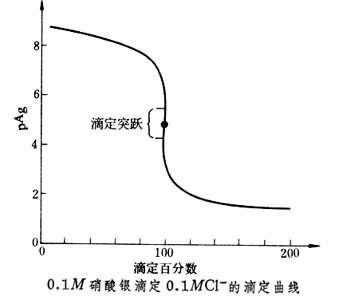
此法方便、准确,应用很广,主要测定Cl-,如水中的Cl-。也可测定Br-。试液中能与Ag+生成沉淀的弱酸根离子(如PO婯、AsO婯、S2-、C2O娸)对测定有干扰,可以提高溶液的酸度,使它们不与Ag+生成沉淀,以消除干扰,但此时铬酸银也不沉淀,也就不能以铬酸钾为指示剂,如果有以上干扰离子存在,要用福尔哈德法。
福尔哈德法
(1)直接滴定法 在含 Ag+的酸性试液中,加入铁铵矾 [NH4Fe(SO4)2] 为指示剂,以硫氰酸铵NH4SCN为滴定剂,先生成硫氰酸银白色沉淀,当红色的FeSCN2+出现时,表示Ag+已被定量沉淀,指示终点已到达。此法主要用于测Ag+。
(2)返滴定法 在含卤素离子的酸性溶液中,先加入一定量的过量的硝酸银标准溶液,再加入指示剂铁铵矾,以硫氰酸铵标准溶液滴定过剩的Ag+,直到出现红色为止。以测定Cl-为例,其反应为:
Cl-+Ag+→AgCl↓
Ag++SCN-→AgSCN↓
SCN-+Fe3+→FeSCN2+
硝酸银与硫氰酸铵用量之差即欲测的 Cl-的量。此法的优点是选择性高,不受弱酸根离子的干扰。但在测定Cl-时,由于氯化银的溶解度比硫氰酸银大,在到达终点时将有部分的Cl-由沉淀转入溶液,使测定值偏低。如果加入硝基苯,将沉淀包住,可以防止其转化,而得到更准确的结果。
法扬斯法
在中性或弱碱性的含 Cl-试液中加入吸附指示剂荧光黄HIn,溶液显示In-的黄绿色。当用硝酸银滴定时,在到达等当点以前,Cl-处于过剩状态,氯化银沉淀的表面吸附Cl-,使沉淀表面带负电,溶液仍显示In-的黄绿色。在等当点后,Ag+过剩,沉淀的表面吸附Ag+而带正电,它进一步吸附带相反电荷的In-,使沉淀结构改变,沉淀表面显示粉红色,从而指示终点已到达。此法的优点是方便。为使终点明显,可加入糊精以增大沉淀的表面。滴定时应注意避免阳光直射以防止氯化银沉淀分解,还要控制溶液的酸度。
溶液标定
银量法中的硝酸银标准溶液可用基准物质氯化钠标定;硫氰酸铵溶液可用已标定的硝酸银标准溶液来标定。