[拼音]:danbai jimei
[外文]:protein kinases
一类能使蛋白质磷酸化的酶。它能够把腺苷三磷酸(ATP)上的γ-磷酸转移到蛋白质分子的氨基酸残基上。在大多数情况下,这一磷酸化反应是发生在蛋白质的丝氨酸残基上。即:
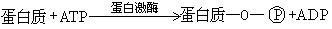
50年代出现的蛋白激酶术语指催化酪蛋白,卵黄高磷蛋白或其他蛋白质磷酸化的酶。70年代在哺乳动物的十多种组织器官中又发现了一类很重要的蛋白激酶──环腺苷酸(cAMP)蛋白激酶,以后在昆虫和大肠杆菌中也有报道。
蛋白激酶在细胞内的分布遍及核、线粒体、微粒体和胞液。一般分为3大类。
(1)底物专一的蛋白激酶:如磷酸化酶激酶,丙酮酸脱氢酶激酶等。
(2)依赖于环核苷酸的蛋白激酶:如环腺苷酸(cAMP)蛋白激酶,环鸟苷酸(cGMP)蛋白激酶。
(3)其他蛋白激酶:如组蛋白激酶等。
cAMP蛋白激酶以活化型和非活化型两种形式存在于生物体中,它们的比例受到多种激素的调节控制。cAMP蛋白激酶是由 4个亚基组成──两个能与cAMP结合的调节亚基 (R)和两个非活化的能催化磷酸基团转移的催化亚基(C)。如果细胞内 cAMP浓度升高则cAMP蛋白激酶解离成调节双亚基和两个活化的催化亚基(见图)。

蛋白激酶在供体ATP和活化剂钙离子(吿)存在下,能把低活性的磷酸化酶激酶磷酸化,使它变为高活性的磷酸化酶激酶,后者又能把低活性的磷酸化酶b经磷酸化转变成为高活性的磷酸化酶 a,从而使糖原降解顺利进行。在这同时,蛋白激酶又能使高活性的糖原合成酶a磷酸化成为低活性的糖原合成酶b,使糖原合成速度减慢。这样在cAMP浓度的调节下使糖原的生成和降解代谢达到平衡。
80年代发现了酪氨酸蛋白激酶,它可以催化自身磷酸化,也可以磷酸化其他的蛋白质。其磷酸化反应专一地发生在特定的酪氨酸的羟基上。某些肿瘤病毒的变态蛋白以及一些生长因子的受体具有酪氨酸蛋白激酶活性。