[拼音]:yuandianchi
[外文]:primary battery
一种只能使用一次的化学电源,又称一次电池。电池内的活性物质有限且直接装配在电池内部,不论连续或间隙放电,只要两个电极中的任何一个电极的活性物质反应至终点,电池即不能再用。所以原电池的容量,即能放出的电量是有限度的。少数原电池在一定条件下虽然也可用充电恢复部分容量达几个循环,但这种由不可逆性较大的电极系统构成的原电池,充电并不可靠。
原电池是一个完全独立的电源,可以是单体电池,也可组装成电池组,且往往做成全密封式,可按任何方位放置,使用十分方便,广泛用于小型便携式电子设备上。
简史
原电池的发展已有 100多年历史。1865年G.勒克朗谢研制出第一只实用的锌│二氧化锰原电池(见彩图),随后又将电解液吸收于纸层或加淀粉形成的浆状薄层上,构成了干电池。由于性能尚好、适用温度范围广、价廉,迄今仍是产量最大、应用最广的原电池品种。1945年S.鲁宾研制出碱性锌│氧化汞电池并首先做成扣式结构。目前,扣式电池(图1)已成为与小型、微型电子设备配套使用不可缺少的元件。


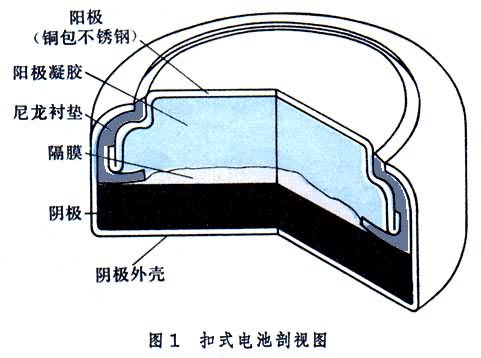
50年代初开始商品化的碱性锌│二氧化锰电池,在国际市场上已与历史悠久的干电池竞争并有超过或逐渐取代的趋势。同一时期相继研制的各种贮备电池已广泛在导弹、火炮、鱼雷等方面应用。60年代以来研制的高能非水溶液锂电池已开始商品化,成为目前化学电源研究中最活跃的领域之一。
水溶液原电池
水溶液中电极的稳定性受到水的热力学分解电位(1.23伏)的限制。原则上负电极的电势不能比在同溶液中的氢电极电势负,而正极不能比氧电极的电势正,除非这种热力学不稳定性引起的水分解反应的动力学反应速率很慢。水溶液中的锌电极就是一个例子,锌具有活性高、当量低、价格便宜、易加工等优点,但根据热力学的观点,锌在水溶液中是不稳定的,它会自发与水反应而氧化,同时析出氢,造成电池自放电,然而锌上氢析出超电势很高,且适当汞齐化处理就能显著地抑制自放电过程,使锌在中性和碱性水溶液中有良好的稳定性,是目前水溶液中可使用的电负性最高的金属阳极材料。水溶液中锌系列原电池主要有锌│二氧化锰、锌│氧化汞、锌│氧化银、锌│空气电池等。
中性锌│二氧化锰电池俗称干电池,负极为锌,它在圆形结构中一般兼作电池容器。正极活性材料为二氧化锰。电解液为含氯化锌和淀粉的氯化铵水溶液,通常形成凝胶。二氧化锰放电机理比较复杂,多数人认为是电子和质子进入二氧化锰晶格的嵌入固态机理,这解释了锌│二氧化锰电池连续放电性能差、不适于较大电流放电和放电电压不平稳等现象。电池的总反应为:
Zn+2MnO2+2NH4Cl─→Zn(NH3)2Cl2+2MnOOH
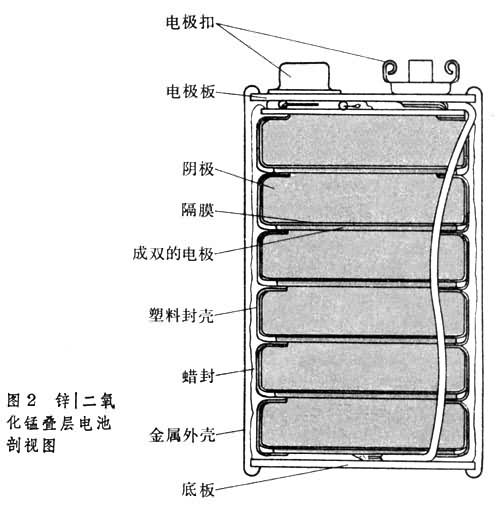
目前正在发展纸板式和薄膜化干电池,用吸饱电解液的特种纸板或高分子薄膜代替糊层电解液,以提高电池放电容量(图2)。
 碱性锌│二氧化锰电池
碱性锌│二氧化锰电池
俗称碱性干电池,电解液为氢氧化钾水溶液。由于羟基氧化锰和氢氧化锰在强碱中有明显的溶解度,有可能部分通过溶液,按溶解-沉淀机理进行电化学反应,加之在圆形电池里,采用置于电池内部的锌屑代替普通干电池的整体锌筒,因而放电容量比普通干电池要高3~5倍,且可用较大电流放电,低温和贮存寿命也较好。缺点是价格较高,必须有良好的防漏碱措施。
锌│氧化汞电池正极材料为混有石墨的氧化汞,电解质为氢氧化钾水溶液。由于氧化汞放电时产生的OH-与锌极放电时消耗的OH-等当量,电解液实际用量很小,一般每安培小时只需1毫升;锌氧化时体积的膨胀与氧化汞还原时体积的减少相接近,电池内部不必留下自由空间;正极活性材料利用率很高;因而成为目前水溶液原电池中比能量(单位体积的能量)较高的品种之一,易小型化,放电电压平稳,自放电小,贮存寿命长,但价格高,需用贵重的氧化汞为原料。
锌│空气电池正极活性物质是取之不尽的空气中的氧,具有价廉、比能量高、放电后可更换锌极再用等优点。但由于碱液会通过空气电极吸收空气中的二氧化碳,大大限制了其应用。扣式锌│空气电池部分地克服了这些缺点,并已商品化,其重量比能量较扣式锌│氧化银电池还高,但不适于在紧密闭合系统里使用。
其他电活性更高、当量更低、价廉、资源丰富的负极材料有镁、铝等。但尚未能获得满意的稳定性和可靠性。
贮备电池
一种使用前须经激活才能进入工作状态的原电池。通常是设计成装配好的电池不与电解液接触或电解液处于惰性,使用时迅速使电解液与电极接触或使其具有活性,这个过程称为激活。激活前电池可长期贮备5~15年,激活后通常只工作几十秒到几十分钟。由于只在短时间内使用一次,自放电相对居于次要,因而可采用活性高的电极材料和腐蚀性强的电解液,以适应强功率放电的要求。其缺点是一般不能事先直接检测,且需要激活的辅助设备或元件。目前,按激活的方式区分,有液体激活(如供鱼雷动力、海上救生讯号、气象探测等用的海水激活电池)、气体激活和热激活(如供火炮、炸弹等引爆用的 400~600°C 激活的钙│铬酸钙引信电池)三类:
液体激活电池主要有海水激活和电解液激活两种。海水中的氯离子能有效地减少镁电极的钝化现象,有利于提高工作电压和放电电流。镁被海水腐蚀产生的反应热可使电池在-70°C环境下工作,因而镁合金电极是目前海水激活电池常用的负极活性材料。正极活性材料有氯化银、氯化铜、氯化铅等。激活时只须注入海水或把电池浸入海水即可。激活时间为几秒到几分,工作时间一般为几分到几小时。主要用于鱼雷动力电源、潜艇声纳浮标、气象和地球物理高空探测以及海上救生讯号等。
电解液激活电池是以酸或碱的水溶液快速注入电池使之进入工作状态的贮备电池,由电池组和激活辅助装置构成,后者包括贮液器、加热器、电液分配系统和注液动力源。加热器使电池组可在低温下工作。电液分配系统使电液能均匀注入每个电池并减少残留于注液器中的电液引起的漏电和噪声。注液动力源有火药引爆、化学燃烧、发射与飞行过程的惯性力和离心力以及高压气体等。激活辅助装置必要时还可在激活后与电池组自动分离。这类电池的特点是激活快,通常小于1秒,激活后以强功率放电,达几十秒至几分,适用于机动性高的战术导弹。比较成熟的电池有锌│重铬酸钾、锌│氧化银等。采用铝、锂作负极的液体激活电池正在研制中。
气体激活电池硫氰酸铵盐类能在氨中溶解或很快吸收氨气而潮解形成氨溶液,其电导率与水溶液相近,用它作电解质的电池可构成氨激活电池,常用的负极为镁、锌、铅;正极为氧化铅、二氧化锰等。其特点是低温性能好,-60°C下放电容量和25°C时基本相同。用氨气激活,活化时间较长;改用液氨,激活时间可小于1秒。氯气激活的气体贮备电池也在研制中。
热激活电池是一种贮存期间电解质为基本上不导电的无活性固体,使用时以某种方式加热,使电解质熔融而激活的贮备电池。常用的负极有钙、镁等;正极有重铬酸钾、五氧化二钒、三氧化钨等;电解质为氯化钾-氯化锂或溴化钾-溴化锂低共熔盐;工作温度400~600°C。比较成熟的电池有钙│铬酸钙电池。激活方式通常为引燃加热片,加热片为金属粉末(如锆、镁)和氧化剂(如高氯酸钾、铬酸钡)压成,激活时间小于1秒适用于低温环境,机械强度高,激活后可强功率工作几秒到十几分,用于导弹、核武器、火炮和炸弹的近爆引信电源。目前正努力发展60分钟以上大功率动力热电池;用锂或锂合金阳极以及激活后电解质仍为固体的固体电解质热激活电池,也受到一定重视。
常温固体电解质电池
一种电解质为固态离子导体的原电池。这种固体电解质在常温下即有较高的离子导电率,称为快离子导体,基本上没有电子导电。因而电池自放电很小,可长期贮存(达10~20年),适用温度范围宽,不存在漏液和排气问题。电解质本身兼作隔膜,结构简单,组合方便,耐振动、冲击、旋转,易微型化,是目前可能做到体积最小的电池品种。缺点是放电电流密度很小、价格高。适用于需要长期不间断地以微小电流工作的特殊场合,如心脏起搏器。常用固体电解质有Ag+、Cu+、Li+、Na+、H+、F-等离子导体,其中RbAg4I5是目前已知导电率最高的常温固体电解质。负极材料决定于电解质的导电离子类型,常用的有锂、银等;正极材料为碘或碘化物。如Ag│RbAg4I5│RbI3、Ag│RbAg4I5│(CH3)4NI3电池,开路电压 0.67伏,典型工作电流为10-6~10-3安培。近来,高电导率常温固体电解质的进展和低能耗微型化电子设备的发展,使常温固体电解质电池有良好的应用前景。
非水溶液电解质电池
以溶有盐类的非水溶剂为电解质的原电池。主要优点是可使用在水溶液中难以实现的高活性金属阳极,特别是锂。一个锂单体电池,工作电压可高达3伏,比能量可高达每千克电池200~600瓦·时,低温和储存性能均较好。缺点是电池密封要求很高,溶剂和盐类都要严格脱水,现用电解液的电导比水溶液电解质要低1~2个数量级,不适于大电流放电,且锂表面往往处于半钝化状态,使放电初始有电压滞后现象,某些品种电池在重负荷、短路或某些尚不清楚的情况下会发生爆炸事故。这种电池目前主要用于携带式电子设备电源。
常用的有机溶剂为碳酸丙烯酯、Y-J内酯、乙腈、二甲基甲酰胺等。溶解于有机溶剂的无机盐有高氯酸锂、氯化铝锂、氟硼酸锂、溴化锂等。正极活性物质有氟化物、氯化物、硫化物和金属氧化物。无机溶剂有亚硫酰氯、磷酰氯、液体二氧化硫等,它们不仅作为溶剂而且本身也是正极活性物质。
目前研究较为成熟并商品化的锂非水溶液电池为:锂│聚氟化碳、锂│二氧化硫、锂│亚硫酰氯、锂│二氧化锰等,后者是已知锂电池中比较安全的品种之一。非水溶液锂电池只有20年左右的历史,是一类具有发展潜力的新型高能电池。