[拼音]:pingbi xiaoying
[外文]:shielding effect
多电子原子中核电荷(见原子核)对某一电子的吸引作用,部分地被其他电子对该电子的排斥作用相抵消的效应。氢原子的核电荷和核外电子数都是1,不存在其他电子的作用,这个电子的能量为:
En=-2.17×10-21/n2 (kJ)
式中n为主量子数。
在多电子原子中,对于某电子而言,由于其他电子对它的斥力,核对它的引力减弱了。如锂原子的核电荷为3,核外第1层有2个电子,第2层有1个电子,后一个电子因受前2个电子的斥力,所受“净引力”减弱了。
屏蔽效应可表示为:
Z*=Z-σ
式中Z*为有效核电荷数;Z为核电荷;σ为屏蔽常数,它表示因电子间斥力被屏蔽掉的部分核电荷,因此原子内某电子的能量为:
En=-2.17×10-21(Z-σ)2/n2 (kJ)
20世纪30年代,美国科学家J.C.斯莱特根据实验结果提出计算屏蔽常数的规则:
(1)把原子中的电子写成以下几组:(1s)、(2s2p)、(3s3p)、(3d)、(4s4p)、(4d)、(4f)、…等。
(2)处于右边的电子对左边各组电子不起屏蔽作用,即σ=0。
(3)(nsnp)相互间的屏蔽常数σ=0.35,对于1s,σ=0.30。
(4)(n-1)层电子对ns、np层电子屏蔽的σ=0.85。
(5)(n-2)层及更里层电子对 n层电子的屏蔽是完全的,即σ=1.00。
(6)处于左边各组电子对nd、nf的屏蔽常数σ=1.00。
根据这些规则就能求得有效核电荷。如氮的核外有7个电子(1s)2(2s2p)5,则得:
σ=(2×0.85)+(4×0.35)=3.10
Z*=7-3.10=3.9
即氮原子中对(2s2p)上某电子的有效核电荷为 3.9。又如钒的核外电子为:(1s)2(2s2p)8(3s3p)8(3d)3(4s)2。对4s的屏蔽:
σ=(10×1.00)+(11×0.85)+0.35=19.7
Z*=23-19.7=3.3
即
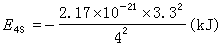
s、p对核电荷屏蔽强于d、f,与s、p电子云径向分布离核较近有关;从另一方面看,nsnp电子受(n-1)层电子屏蔽不完全。
按斯莱特规则计算得到的Z*,虽不够精确,却有助于对原子体积和电负性等的理解。