[拼音]:Alunniwusi dianli lilun
[外文]:Arrhenius ionization theory
一种电离理论:在溶液中电解质自动离解成正、负离子,离子是带电的微粒。
1887年瑞典化学家S.A.阿伦尼乌斯提出电离理论。这一理论提出后得到J.H.范托夫和W.奥斯特瓦尔德的支持,也遭到许多著名科学家的反对,因为这一理论与当时流行的观点不同。
他认为:在电解质稀溶液中,电解质部分电离成离子。在溶液中,溶质的质点数(未离解的分子和离解生成的离子)多于相同质量摩尔浓度的非电解质溶液中溶质的质点数。
根据稀溶液依数性的理论值和实验值可计算溶质的电离度。例如,实验测得0.010Μ氯化钠水溶液的凝固点为-0.036 1℃。设氯化钠的电离度为α,则溶液中溶质的总质点数x推算如下:
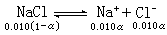
x=0.010(1-α)+0.010α+0.010α=0.010+0.010α
0.010Μ非电解质(α=0)水溶液的凝固点为-0.0186℃,则得:
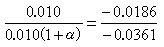
α=94%
表明0.010Μ氯化钠溶液中有94%离解了。
他认为:在溶液中导电的质点是离子而不是分子,离子愈多,导电性愈强。实验结果表明,溶液浓度愈低,其当量电导愈大。无限稀释时当量电导最大,以 Λ∞表示,此时电离度为 100%。如测得某浓度时的当量电导为Λ,则其电离度α为:
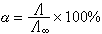
他认为:电导是两极间的电势差导致溶液中正、负离子作定向移动,而不是靠电流来分解分子。
阿伦尼乌斯又用电离理论解释了强酸溶液与强碱溶液的中和热都相同,是由于发生了下列反应:
H++OH-─→H2O ΔH°=-57.32kJ/mol
证明盐酸、氢氧化钠等在溶液中均以离子状态存在。