[拼音]:hejin jiegou
[外文]:structure of alloy
两种或两种以上金属元素(或其基本的一种是金属元素)相互结合而成的稳定的、具有金属性质的物质称为合金。能形成合金是金属的最重要性质之一。不同金属元素间相互作用的方式有四种:
(1)无论在固态或液态下都不作用;
(2)在液态下相溶、在固态下形成共晶体系或局部互溶的共晶体系;
(3)在固态下形成连续固溶体;
(4)在固态下形成一种或几种金属互化物。
固溶体两种或多种元素相互溶解而形成的均匀晶相(各元素含量变化未破坏晶体的结构)。固溶体有置换式、填隙式和缺位式三种基本类型:
(1)置换固溶体 单胞中的原子数目保持与纯溶剂相同,由一种元素替代另一种元素或替代一个化合物中的某一元素,或一个化合物替代另一个化合物(图1)。形成置换固溶体的条件是:相互替代的组元应该具有相同的晶胞形状,原子半径差不超过15%,电负性和电子结构相近。

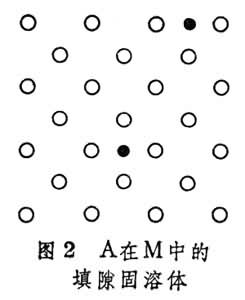
(2)填隙固溶体 单胞中的原子数多于纯溶剂,溶质原子占据在溶剂点阵的间隙(图2)。溶剂多半是金属,而溶质则是原子半径较小的非金属,如氢、硼、碳、氮等。
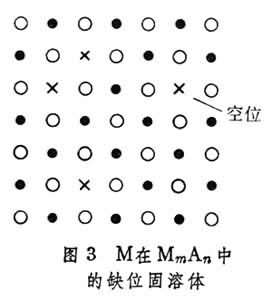
(3)缺位固溶体 单胞中的原子数目少于纯溶剂。在这种固溶体中,作为溶剂的只能是化合物。当元素M溶在MmAn化合物中时,M仍占据MmAn中M应占据的位置,而属于A元素的部分位置则空着(图3)。
当固溶体的本征热能kT(k为玻耳兹曼常数,T为热力学温度)远大于原子间的作用能U时,则固溶体处于无序状态,原子按组成具有统计分布,在晶格的同一等效点上找到原子的几率为其原子百分数。当kT远小于U时,热无序效应可被忽略,原子的分布由原子间相互作用能为最低的条件来决定。每一原子的周围倾向于存在他种原子,不同的原子在晶格中占据各自的等效点,形成有序分布。有序化转变温度Tc≈U/k。Cu3Au和CuAu3在低于有序化温度时,空间群从Fm3m 转变为Pm3m,原子分别占据立方体的面心位置和顶点位置。CuAu有序化的结果可形成空间群为P4/mmm的CuAu-Ⅰ超结构,Cu与Au原子垂直于四次轴分层交替分布。由于热处理温度和成分不同,还可形成堆垛层错属于正交晶系b=na的有序超结构CuAu-Ⅱ相。
金属互化物两种或两种以上的金属元素相互化合形成的结构和性能都不同于原来金属元素的化合物。
(1)电子化合物也称休谟-饶塞里相 其结构主要由电子浓度来决定。电子浓度的定义是每个原子的平均价电子数,对于缺陷结构,则用单胞的价电子数表示。对于面心立方结构 α相,其极限电子浓度为7/5;体心立方β相为3/2;对于复杂立方结构,每单胞含52个原子的γ相为21/13;而对于六方密堆积ε相和ζ相则为7/4。电子化合物的极限化学成分相当于该结构的第一布里渊区被填满。
(2)拉夫斯相 其理想化学式为AB2型。这类相的形成主要取决于两元素的原子半径比。其理想比值rA/rB为1.225,其实际存在范围为1.05~1.68,大部分为1.1~1.4。半径比在这个范围内的等原子化合物,通常形成氯化铯结构。拉夫斯相有三种不同堆垛,与其密切相关的结构有:空间群为Fd3m,每单胞含化合式单位Z=8(Z为配位数)的MgCu2(C15)型结构;空间群为P6/mmc,Z=4的MgZn2(C14)型结构;空间群为P6/mmc,Z=8的MgNi2(C36)型结构。三种结构类型所占的比例分别为68%、30%和2%,拉夫斯相的结构特点是配位数大和堆积系数高。
(3)正常价化合物 其特点是符合价键规律,这类结构以离子键或共价键为主,它们通常含有元素周期表的ⅣB、ⅤB或ⅥB的一种类金属元素,如具有氟化钙型结构的Mg2Si、Mg2Ge、Mg2Sn、Mg2Pb等,以离子键为主。Ⅲ-Ⅴ族化合物具有闪锌矿型结构,以共价键为主。(见金属晶体)
间隙化合物由一种金属元素(如过渡元素)与氢、硼、碳、氮、硅可形成具有金属性质的化合物。当rx/rm≤0.59时(rx与rm分别为非金属与金属原子半径),则金属原子组成面心立方或六角密堆积,在个别的情况下组成体心立方或简单六方,非金属原子占据属于某一等效点系的间隙位置,形成简单化学配比MX2、MX、M2X、M4X型的间隙化合物。由于氢、硼、碳、氮、硅的第一电离势很小,非金属原子的部分价电子转移到过渡金属的d带,使间隙化合物具有高熔点和高硬度。