[拼音]:youji yuansu dingxing fenxi
[外文]:organic elemental qualitative analysis
有机分析的一个分支学科,指有机化合物中碳、氢、氧、氮、硫、卤素、磷、硅、硼和有关金属元素的定性分析,不仅能提供关于有机物的组成和鉴定方法的信息,而且在结构分析中对质谱法、红外光谱、紫外光谱和核磁共振谱图的解释是不可缺少的。定性分析通常分两步进行:先使有机物分子破坏,变成无机离子;然后用适当的试剂或仪器分析方法检验生成的无机离子。通常破坏有机物都是应用较强的试剂,因此对于试样的本性要有初步了解,例如有无爆炸性或剧毒,以便采取适当的防护措施。
试样的分解
钠熔法把有机化合物加到灼热的金属钠中就起猛烈的反应,其中的碳、氢、氧、氮、硫、卤素生成碳、一氧化碳、二氧化碳、氰化钠、硫化钠和卤化钠。当金属钠不足时,氮和硫生成硫氰化钠。但金属钠过量时,硫氰化钠又分解为氰化钠和硫化钠:
NaCNS+2Na─→NaCN+Na2S
使用过多的金属钠将使萃取液的碱性太强,应该避免。熔化物用水萃取后,检验萃取液中的阴离子。如果用金属钾代替金属钠则效果更好。
钠熔法的缺点是氮往往会漏检,特别是低沸点的胺、胺盐和酰胺以及有爆炸性的化合物(例如重氮盐和多硝基物等)。改进的方法是预先在试样中加入少量的萘或蔗糖;或改用其他的活性金属代替钠。再如,对于沸点很低的试样使用钠熔法往往也有困难。用镁和碳酸钾的混合物作熔剂,可克服这些缺点。
锌-碳酸钠熔化法此法中含硫物生成的硫化锌不溶于水,因此需要在滤渣中检验硫:
ZnS+2H+─→Zn2++H2S
H2S+Pb2+─→PbS↓+2H+
碳酸锂在热水中的溶解度比碳酸钾或碳酸钠小,用水萃取后可以滤去,以免以后酸化萃取液时产生大量的二氧化碳气,将氰化氢、硫化氢、卤化氢带走。因此,用碳酸锂代替碳酸钾或碳酸钠可以进行微量分析。
氧瓶法将有机化合物在氧气中燃烧,使所含的元素变成相应的氧化物,用加有几滴30%过氧化氢的2%氢氧化钠溶液吸收(分析金属元素有时改用2%盐酸或2%硝酸作吸收液)。然后检验吸收液中的离子。这种方法的优点是试样用量小、分解完全和操作简单,可以在锥形烧瓶或分液漏斗中进行,但需要配一个特制的磨口塞子,在塞子下面熔接一段铂丝(有时也可用镍络丝代替)。把试样(难分解的试样,例如某些有机氟或硅化合物应该混入少量的过氧化钠)用一小块滤纸包好后,系在铂丝上。在氧瓶中装好吸收液和充满氧气(有时不充氧气就在空气中进行也可)后,用火点着滤纸,放进瓶中,迅速塞紧塞子,燃烧完毕后放冷,摇匀。
元素的鉴定
用钠熔法和锌-碳酸钠熔化法分解的试样其中的元素可用以下方法鉴定:
(1)硫可用亚硝基铁氰化钠法(式1)、乙酸铅法(式2)、叠氮钠法(式3):
S2-+[Fe(CN)5NO]2-─→[Fe(CN)5NOS]4- (1)
S2-+Pb2+─→PbS (2)
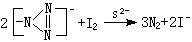 (3)
(3)
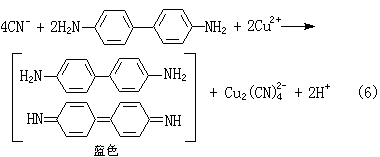
(2)氮可用对硝基苯甲醛-邻二硝基苯法(式4和5)、4,4′-二氨基联苯-乙酸铜法(式6):
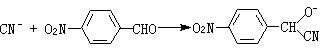 (4)
(4)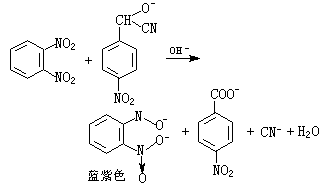
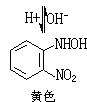 (5)
(5)
(3)氮和硫可用硫氰化铁法(式7):
3CNS-+Fe3+─→Fe(CNS)3 (7)
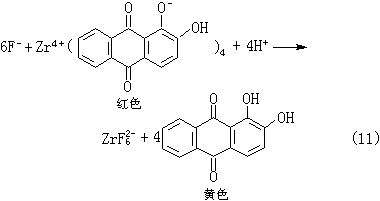
(4)氯可用卤化银法(式8),溴可用氧化法(式9),碘用亚硝酸氧化法(式10),氟用茜素-氯化锆法(式11):
Cl-+Ag+─→ AgCl (8)
2Br-+Cl2─→ Br2+2Cl- (9)
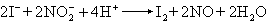 (10)
(10)
(5)砷可用硫化砷法(式12)、砷酸银法(式13):
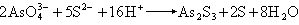 (12)
(12)
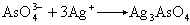 (13)
(13)
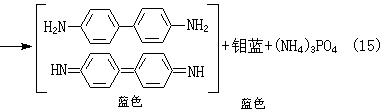
(6)磷可用磷钼酸铵法(式14)、钼蓝法(式15):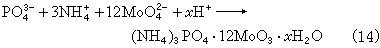 (NH4)3PO4·12MoO3·xH2O+2H2N
(NH4)3PO4·12MoO3·xH2O+2H2N
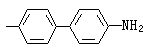
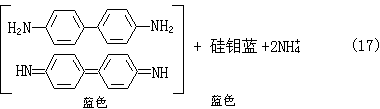
(7)硅用硅钼蓝法(式16和17):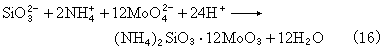 (NH4)2SiO3·12MoO3+2H2N
(NH4)2SiO3·12MoO3+2H2N
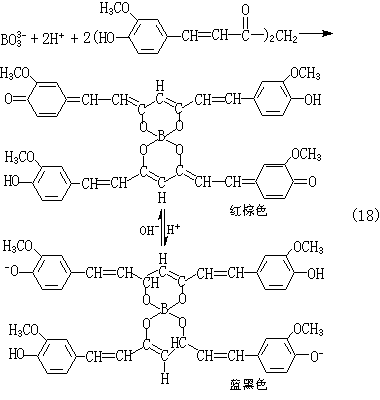
(8)硼可用姜黄法(式18):
 用氧瓶法分解的试样
用氧瓶法分解的试样
其中的元素可用以下方法鉴定:
(1)硫可用硫酸钡法(式19)、玫瑰红酸银法(式20和21):
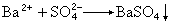 (19)
(19)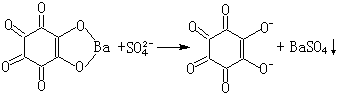 (20)
(20)
红棕色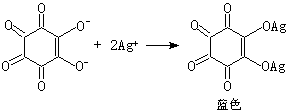 (21)
(21)
(2)氮可用二苯胺法(式22):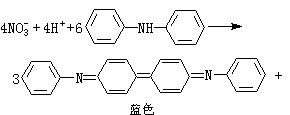
4NO+8H2O (22)
氧的分析有机化合物中的氧一般不直接分析,也没有简单的分析方法。如有必要可将试样在氮气流中灼烧到950~1000°C,使分解物通过1100~1150°C的炭粒,氧变为一氧化碳气,然后在120°C与五氧化二碘反应:
C+O─→CO
5CO+I2O5─→5CO2+I2
钠珠法分析氮与硫试样与新制的钠珠和甲苯放在一起加热,氮变成氨,硫变成硫化钠。前者可用石蕊试纸检验,后者酸化后用乙酸铅试纸检验。
拜耳斯坦法检验氯、溴、碘含氯、溴、碘的有机物与氧化铜在煤气灯的氧化焰中一起灼烧,可以产生绿色的火焰。由于氟化铜不能挥发,不能使焰色变绿。此法非常灵敏,但不可靠,原因为:
(1)卤素作为杂质存在,也能使灯焰显绿色;
(2)挥发性很强的试样在氧化铜没有灼热前已挥发殆尽,因而漏检;
(3)许多不含卤素的化合物,例如脲、硫脲、吡啶、喹啉或某些羧酸,由于能产生挥发性的铜盐,也使焰色变绿。
硝酸银试纸检磷法膦化合物在钠熔法中有磷化氢气生成,可使硝酸银试纸变黑。这是分析膦化合物的简便方法,但是膦酸酯类必须预先在试样中加入蔗糖,然后进行钠熔法。
汞的分析有机汞化合物在钠熔法中往往容易挥发,可与无水碳酸钠混匀后加热,生成的汞蒸气可使白色的碘化亚铜迅速变成猩红色或桃红色:
Hg+CuI─→HgI+Cu
本法十分灵敏,但如有氨气或硫化氢气产生时有干扰;前者可用焦硫酸钾消除,后者则用氧化铅去除。
其他的金属元素把试样灼烧成灰分后,进行化学分析或仪器分析。