[拼音]:dianchi diandongshi
[外文]:electromotive force of cell
单位正电荷从电池的负极到正极由非静电力所作的功。在等温等压可逆的条件下,在电池中进行电极化学反应:
aA+bB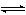 cC+dD
cC+dD
且该反应只作电功,则化学反应的吉布斯函数变化值ΔG等于电池所作的功,即-ΔG=nFE或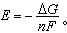 式中E为可逆电池的电动势;F为法拉第常数;n为反应中电子转移数。
式中E为可逆电池的电动势;F为法拉第常数;n为反应中电子转移数。
可逆电池的电动势和参加可逆反应的各物质的活度之间的关系由能斯脱公式表示:
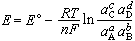
式中E°为参加反应的各物质的活度均为1时的电动势,称可逆电池的标准电动势;R为气体常数;T为热力学温度;aA、aB、aC、aD 为参加可逆反应各物质A、B、C、D的活度。
电池电动势的测量补偿法测量电动势的线路如图所示。
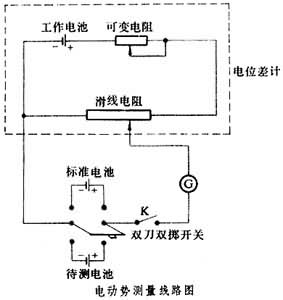
电池电动势就是电池中电流为零时的两极电位。先将双刀双掷开关置于标准电池一方,调节滑线电阻到相当于标准电池电位 (1.01864伏)的位置,再调节工作电池回路中的可变电阻,使按钮K按下时检流计 G指针在零的位置。将双刀双掷开关置于待测电池一方,调节滑线电阻使K按下时检流计指针在零的位置,此时滑线电阻所对应的电位就是待测电池的电动势。
应用(1)计算平衡常数;化学反应处于平衡态时,ΔG=0,即E=0。由能斯脱公式可得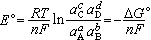 。令
。令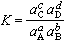 ,K就是平衡常数,因此,一个化学反应如果能够安排成可逆电池,则它的平衡常数和ΔG°可通过测量电动势来计算。
,K就是平衡常数,因此,一个化学反应如果能够安排成可逆电池,则它的平衡常数和ΔG°可通过测量电动势来计算。
(2)计算焓变和熵变;将吉布斯-亥姆霍兹公式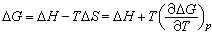 代入公式E=
代入公式E=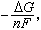 可得
可得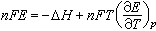 。式中ΔH、ΔS分别为化学反应的焓变、熵变;
。式中ΔH、ΔS分别为化学反应的焓变、熵变;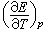 为一定压力下电池电动势的温度系数。因此通过测量不同温度下的电动势可计算可逆电池中化学反应的 ΔH、ΔS等。该法是求热力学性质的精度最高的方法。
为一定压力下电池电动势的温度系数。因此通过测量不同温度下的电动势可计算可逆电池中化学反应的 ΔH、ΔS等。该法是求热力学性质的精度最高的方法。
(3)电动势与化学分析;E°已知时,通过测量电池电动势 E可求出参与反应物质的活度, 这是电化学分析法中电位法和电位滴定的基础。如参与反应的物质的浓度已知,则可求出活度系数,电池电动势法是测电解质平均活度系数的重要方法。