[拼音]:mopingheng
[外文]:membrane equilibrium
如果小离子和溶剂分子都能通过半透膜,在平衡时电解质在膜两边的浓度应相同。如果有大分子电解质存在,则它的大离子不能透过半透膜,当这一体系达到渗透平衡后,小离子在膜两边的浓度就不相等了,这种现象称为膜平衡。由于这一现象是F.G.唐南发现的,又称唐南平衡。例如,将浓度为c1的蛋白质钠盐(Na+R-)溶液与浓度为c2的氯化钠(Na+Cl-)溶液用半透膜隔开(见图)。
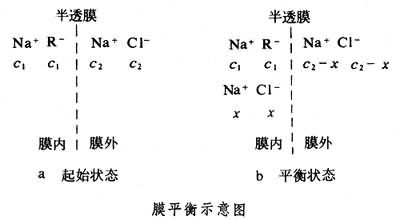
在起始状态,因为蛋白质大离子R-不能扩散到膜外,而Na+与Cl-等小离子可以通过膜,为了保持膜两边溶液为电中性,扩散时须满足膜内外Na+交换的数目相等和等量的Na+与Cl-同时由膜外扩散到膜内的条件。设有浓度为x 的小离子由膜外进入膜内,最后的平衡状态如图中 b所示。由热力学的平衡条件可知,小离子在膜内浓度的乘积等于其膜外浓度的乘积:
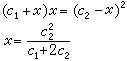
此式表明,进入膜内的氯化钠浓度x 的大小与起始时膜内蛋白质钠盐的浓度c1和膜外氯化钠的浓度c2有关。当c2》c1时,x≈c2/2,表明氯化钠约有一半进入膜内,即平衡时膜内外氯化钠浓度大致相等。若c1》c2,x=c娤/c1≈0,即氯化钠几乎不进入膜内。在生物体内细胞膜是一种半透膜,细胞里的蛋白质和细胞外的体液即存在膜平衡。膜平衡原理可说明细胞膜的透过性问题。当细胞内蛋白质浓度很小或细胞外电解质浓度很大时(c2》c1),细胞膜对于小离子就显得完全能通过;当细胞内蛋白质很浓时(c1》c2),小离子几乎完全通不过细胞膜。此外,膜平衡原理还可以说明渗透细胞膜的同一种离子为何在细胞的内外浓度不相同。例如,若起始时NaR与NaCl的浓度都等于c,则达到膜平衡时膜外的[Na+]为0.67c,[Cl-]为0.67c;膜内的[Na+]为1.33c,[Cl-]为0.33c。
由于小分子电解质的存在对蛋白质溶液的渗透压有很大的影响,测定渗透压时必须消除其影响,方能得出正确的结果。膜平衡原理解决了蛋白质渗透压测定的问题。由于膜平衡的作用,膜内蛋白质溶液对膜的渗透压Π为:
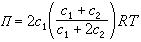
式中R为气体常数;T为热力学温度。这时蛋白质溶液的渗透压不仅与蛋白质浓度c1有关,而且受膜外电解质浓度c2的影响。若在测定时,使c2c1,则可得:
Π=c1RT
因而蛋白质溶液的渗透压只由其浓度决定。