[拼音]:yanghua huanyuan didingfa
[外文]:oxidation-reduction titration
以氧化还原反应为基础的容量分析方法。它以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质;或者间接滴定一些本身并没有氧化还原性,但能与某些氧化剂或还原剂起反应的物质。
此法建立于1789年,当时C.-L.贝托莱以靛蓝为滴定剂兼指示剂,滴定漂白溶液(氯水)。19世纪又相继建立了碘量法、高锰酸钾滴定法、重铬酸钾滴定法、铈量法等。
滴定剂
氧化滴定剂有高锰酸钾、重铬酸钾、硫酸铈、碘、碘酸钾、高碘酸钾、溴酸钾、铁氰化钾、硝酸铵、高铁盐、氯胺等;还原滴定剂有亚铁盐、氯化亚锡、硝酸亚汞、抗坏血酸、亚铬盐、亚钛盐、亚砷酸钠-亚硝酸钠-亚铁氰化钾、肼类等。
氧化还原反应
反应机理往往比较复杂。除主反应外,经常伴随多种副反应,而且反应速率较低。不少氧化还原反应,从相应的氧化-还原电对的标准电极电位差来考虑,是能够进行的,但实际上由于反应速率太低,给滴定带来困难。这样,有些慢的反应就要通过加热或加催化剂(见容量分析中的催化反应)等方法来加速;有些反应,尤其是一些多电子转移的氧化还原反应,很容易引起诱导反应(见容量分析中的诱导反应)或其他副反应,从而影响滴定的定量关系。对于这些干扰反应,应针对具体情况,采用不同的方法加以克服。滴定反应的完全程度与氧化剂和还原剂之间的标准电极电位差有关,电位差越大,反应进行得越完全。
在氧化还原滴定过程中,随着滴定剂的加入,被滴定物质的氧化态和还原态物质的浓度随之改变,氧化-还原电对的电位也随之不断改变,而在达到等当点附近时,电位变化有一个明显的突跃,滴定的等当点可借助仪器分析法(如电位分析法)确定,一般常借助指示剂来判断。
指示剂
自身指示剂有些滴定剂溶液或被滴定物质本身有足够深的颜色,如果反应后变为无色或浅色物质,则其本身就可起指示剂的作用。例如高锰酸钾滴定法中,MnO嬄本身的紫红色就可以用来指示滴定终点,因为还原产物Mn2+几乎是无色的。
显色指示剂有的物质本身并不具有氧化还原性,但它能与氧化剂或还原剂产生特殊的颜色,因而可以指示滴定终点。例如,可溶性淀粉溶液与碘反应,能生成深蓝色或蓝紫色的化合物,当碘被还原为碘离子时,该化合物不复存在,溶液的颜色消失,借此可以指示滴定终点。
本身发生氧化还原反应的指示剂这类指示剂的氧化态和还原态具有不同的颜色。在滴定过程中,当反应达到等当点附近时,由于指示剂由氧化态变为还原态,或由还原态变为氧化态而发生明显的颜色变化,从而指示出滴定终点。较重要的此类指示剂有次甲基蓝、二苯胺磺酸钠、邻苯氨基苯甲酸、邻二氮菲-亚铁等。
预先氧化或还原处理
在氧化还原滴定中,有时还需要在滴定之前,将被测组分氧化为高价状态,再用还原剂滴定;或者将被测组分还原为低价状态,再用氧化剂滴定。这一步骤称为预先氧化或还原处理。处理时所用的氧化剂有过二硫酸铵、高锰酸钾、过氧化氢、高氯酸、高碘酸钾、铋酸钠;还原剂有氯化亚锡、三氯化钛、二氧化硫、各种金属还原剂和金属汞齐等。通常要求这些氧化剂和还原剂与被测物质的反应进行完全,反应快,过量的试剂容易除去,并要求反应具有一定的选择性。
计算
利用当量关系计算氧化还原滴定法的结果比较方便,物质的氧化还原当量E为:
E=W/n
式中W为物质的式量;n为物质在反应中的电子得失数或氧化数的变化。如果被测组分X通过一系列反应得到Z后,再用滴定剂滴定,则 X的当量应根据各步反应的计算关系加以确定:
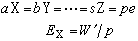
式中a、b、…、s、p为有关系数;W′为aX的式量;e为电子数。当然,也可以直接根据被测物质与滴定剂之间的摩尔计量关系进行计算。