[拼音]:rongliang fenxi
[外文]:volumetric analysis
又称滴定分析。是一种重要的定量分析方法,此法将一种已知浓度的试剂溶液滴加到被测物质的试液中,根据完成化学反应所消耗的试剂量来确定被测物质的量。容量分析所用的仪器简单,还具有方便、迅速、准确(可准确至0.1%)的优点,特别适用于常量组分测定和大批样品的例行分析。
简史
容量分析是古老的分析方法,1729年法国C.J.日夫鲁瓦最早使用容量分析,用纯碳酸钾测定乙酸的浓度,他将乙酸逐滴加到一定量的碳酸钾溶液中,直到不再发生气泡为止。到了19世纪,由于成功地合成了各类指示剂,容量分析得到广泛的应用。
滴定反应
能用于容量分析的化学反应必须符合一定条件,其中最重要的是反应物间有确定的化学计量关系,以氢氧化钠滴定乙酸(AcOH,Ac为乙酰)为例;
AcOH+OH-─→AcO-+H2O
AcOH与NaOH按1:1的摩尔比反应,这就是反应的化学计量关系,它是计算的依据。当加入的NaOH与被测的AcOH的摩尔比正好是1:1的这一点称为化学计量点,也称等当点,滴定应当到此结束。但这时往往没有可被觉察的外部特征,于是,常常需要加入一种指示剂,它能在等当点附近发生颜色变化,以指示滴定终了,这一点称为滴定终点。因此,作容量分析时就必须要有适当的方法确定终点。为使测定准确,化学反应应该进行得比较完全。另外,化学反应的速率还必须足够快,否则就失去迅速的特点。
分类
酸碱滴定法例如用氢氧化钠滴定乙酸以测定食醋的浓度(见酸碱滴定法):
AcOH+OH-─→AcO-+H2O
络合滴定法例如用乙二胺四乙酸的二钠盐Na2H2Y(Y为乙二胺四乙酸根)为络合剂滴定 Ca2+和Mg2+(见络合滴定法),以测定水的硬度:
Ca2++H2Y2-─→CaY2-+2H+
氧化还原滴定法例如用重铬酸钾K2Cr2O7滴定Fe2+(见氧化还原滴定法),以测定铁矿中的铁含量:
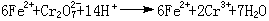 沉淀滴定法
沉淀滴定法
例如用硝酸银 AgNO3滴定Cl-(见沉淀滴定法),以测定针剂中NaCl的含量:
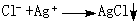 非水滴定
非水滴定
对于不溶于水或在水溶液中反应进行得不完全的物质,在有机溶剂(如冰醋酸、乙醇)中常能够准确滴定(见非水滴定)。
以上都是目视滴定,即利用肉眼观察指示剂在等当点附近的颜色变化以确定终点。如果溶液有颜色或浑浊,或者滴定反应的完全度不高,就要用仪器来检测终点,即用仪器测定滴定过程中体系物理性质的变化来确定终点。例如测定电位、电导、光度的电位滴定(见电位分析法)、电导滴定(见电导分析法)、光度滴定。这些方法的优点是易于实现滴定自动化。
滴定方式
直接滴定如果反应有确定的计量关系,完全度高,速度快,又有适当方法确定终点,最好采用直接滴定。
置换滴定以K2Cr2O7与硫代硫酸钠Na2S2O3的反应为例:由于K2Cr2O7的氧化性较强,它不但能把S2O娫 氧化为S4O婇,还能将S2O娫 部分氧化为SO娸,这样反应就没有确定的计量关系,不能直接测定。如果在酸性的K2Cr2O7溶液中加入过量的KI,就可定量地置换出氧化性弱的I2:
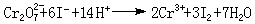
I2与S2O娫 反应时有确定的计量关系:
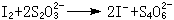
就可以用 Na2S2O3 滴定置换出来的 I2,总的效果仍是Cr2O崻 氧化了S2O娫 。
返滴定盐酸HCL能与碳酸钙CaCO3反应:
CaCO3+2HCl─→CaCl2+CO2+H2O
但恰好加入反应所需的HCl时,CaCO3溶解不完全,因而不能直接滴定。如果先加入过量HCl,加热使CaCO3完全溶解,再用NaOH返滴定HCL,就可测定碳酸钙。
间接滴定Ca2+在溶液中没有价态变化,不能用氧化还原滴定法直接滴定,如果经以下处理,就可以间接滴定:将Ca2+沉淀为CaC2O4:
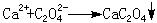
沉淀洗涤后溶于盐酸,生成H2C2O4,用高锰酸钾滴定。
置换滴定、返滴定、间接滴定的应用大大地扩大了容量分析的应用范围。
进行容量分析时,必须有标准溶液和容量仪器,如果试样中还含有别的能与试剂发生反应的物质,必须在滴定前除去(见隐蔽和解蔽)。
测定结果的计算根据滴定中所用标准溶液的浓度和体积就可计算测定结果。以重铬酸钾法测定铁矿中的铁含量为例:试样为W克,K2Cr2O7溶液的浓度为Μ,消耗的K2Cr2O7溶液的体积为V毫升,根据Fe2+与Cr2O崻 按6:1摩尔比反应,则铁的含量为:
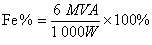
式中A为铁的原子量。