[拼音]:kuangwu xianglü
[外文]:mineralogical phase rule
反映变质岩形成过程中达到热力学多相平衡时,矿物相数与独立组分数之间关系的法则。是吉布斯相律在封闭体系中的应用。由挪威科学家V.M.戈尔德施密特根据吉布斯相律于1911年提出的,又称戈尔德施密特矿物相律。
吉布斯相律是讨论平衡体系内相数、独立组分数和自由度三者之间关系的一般规律,即在平衡条件下,组分将最大限度地形成尽可能少的相。在一般情况下,影响体系平衡状态的因素主要是温度和压力。所以吉布斯相律的一般表达式为
F=C +2-P式中 F(自由度数)为体系中独立可变的强度因素(温度、压力等)的数目。它们在一定范围内可以任意改变而不会引起相的数目的改变。因此,自由度又称为独立变量。P(相数)为体系中平衡共生的相数。岩石学中,一种矿物为一个相,固溶体矿物也算一个相,如发生了固溶体分离,则主、客晶各为一个相。C(独立组分数)为平衡体系中组成各相所需的最小数目的独立物质。例如:
CaCO3+SiO2=CaSiO3+CO2↑该平衡体系由4种物质来描述:CaCO3、SiO2、CaSiO3、CO2。但其独立组分数是3而不是4。
戈尔德施密特认为,在变质地区内,变质矿物组合是按照变质带分布的,每一个变质带代表一定的温度和压力范围,因此由变质反应形成的矿物组合是在温度、压力变化的条件下进行的(即 F=2)。所以相律的一般形式为
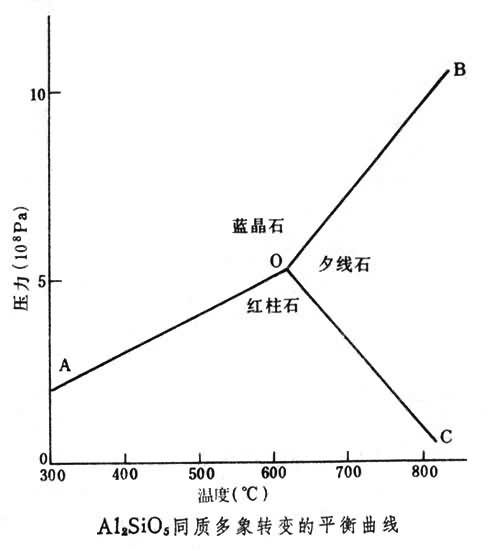
F=C +2-P=2又考虑到一个矿物相并非都是一种组分所组成,因而C≥P,也就是在一定温度和压力范围的封闭体系内,处于稳定平衡的矿物数等于或少于岩石的独立组分数。例如,Al2SiO5的同质多象反应,如图所示。当F=0时,即体系中所有强度因素都为一定值,P=1+2=3,称为不变平衡体系,如图中的O点;而 F=1时,体系中只有一个强度因素可以独立变化,则P=1+1=2,称为单变平衡,如图中OA、OB及OC线;在F=2时,体系中的两个强度因素都可以变化,称为双变平衡体系,如图AOB、BOC、COA双变区。