[拼音]:yanghua huanyuan fanying
[外文]:oxidation-reduction reaction
在反应物之间有电子得失的一类反应。在这类反应中,某种原子失去电子,发生了氧化;另一种原子则得到电子,发生了还原;合起来是同时发生了氧化还原反应。例如,碳和氧化汞在加热时反应生成二氧化碳和汞:
C+2HgO─→CO2+2Hg (1)
肼在空气中燃烧:
N2H4+O2─→N2+2H2O (2)
金属锌置换出硫酸铜溶液中的铜离子:
Zn+Cu2+─→Zn2++Cu (3)
上述三个反应中,汞离子、氧分子和铜离子分别从碳、氮和锌原子上取得电子,前三种物质发生了还原反应,后三种物质发生了氧化反应。通常还把在反应中获得电子、发生还原反应的物质叫做氧化剂;而把失去电子,发生氧化反应的物质叫做还原剂。
一种氧化剂被还原和一种还原剂被氧化总是同时发生、互相依存在一个氧化还原反应之中,是同一个氧化还原反应中的两个半反应。
电子的得失在一个氧化还原反应中,氧化剂获得的电子总数必然等于还原剂失去的电子总数;整个反应体系前后处于电荷平衡状态。例如,在水溶液中Fe3+离子和I-离子反应生成Fe2+离子和I2,可分别写出还原反应和氧化反应的半反应方程式,这两个半反应方程式合在一起就组成氧化还原反应的反应方程式:
还原反应: 2Fe3++2e─→2Fe2+
氧化反应: 2I-─→I2+2e
氧化还原反应:2Fe3++2I-─→2Fe2++I2又如,高锰酸钾和碘化钾在酸性水溶液中的氧化还原反应可表示为:
还原反应: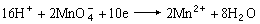
氧化反应: 10I-─→5I2+10e
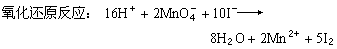 定量衡量物质的氧化还原性质的参数是氧化还原电势。
定量衡量物质的氧化还原性质的参数是氧化还原电势。
对于那些组成和结构比较简单的化合物,判断它们在氧化还原反应中得失电子的情况很容易;而对于那些组成和结构比较复杂的化合物,当不清楚它们的价键性质时,很难判断它们在氧化还原反应中得失电子的情况,就可以采用氧化数这个概念来讨论氧化还原反应,并写出相应的反应方程式。
氧化数是表示物质中元素的表观电荷数。利用氧化数的概念,可以把氧化还原反应定义为:在化学反应中,反应物质中元素的氧化数升高,即发生了氧化;元素的氧化数降低,则发生了还原。
在同一个氧化还原反应中,氧化剂中元素氧化数的降低值,必定等于还原剂中元素氧化数的升高值。例如,在实验室里经常使用高锰酸钾来氧化盐酸,以制备氯气,这个氧化还原反应可以表示如下:
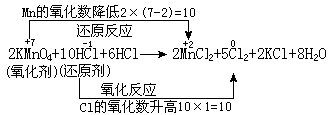
又如过氧化氢在贮存过程中,部分发生分解,转变为水和氧气。这是由于过氧化氢发生了下列自氧化还原反应:
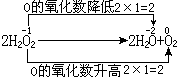 应用
应用
氧化还原是很重要的一类化学反应,在工业生产过程中常常发生许多氧化还原反应。例如,氨经过铂网的催化被空气氧化为硝酸;硫黄燃烧,即被氧化为二氧化硫,再经催化氧化为三氧化硫,以制造硫酸;铬铁矿FeCr2O4与碳酸钠Na2CO3混合,经过氧化焙烧,可以制备 Na2CrO4。几乎所有的金属单质都是利用化学还原反应或电解还原反应制得的。在自然界中,普遍存在和不断发生着氧化还原反应。在生物体内,糖类和脂肪经过酶催化氧化反应。被分解为二氧化碳和水,同时释放大量的能量。这种氧化反应可以下列反应方程式表示:
C6H12O6+6O2─→6CO2+6H2O
CH3(CH2)14COOH+23O2─→16CO2+16H2O