[拼音]:shenchu
[外文]:exudation
血管中的液体、蛋白质或血细胞逸出并进入间质内或体腔内的过程。渗出的物质称为渗出物,如脓肿的脓液,腹膜炎、胸膜炎时的腹水、胸水。渗出是炎症过程的一个重要表现,在致炎因子及炎症介质(如组胺、补体、前列腺素等)的作用下,小血管(小静脉、毛细血管)壁通透性增高,又发生局部血液动力学改变,结果血管内的液体成分(水分、蛋白质、无机盐)及细胞成分(如白细胞、红细胞等)通过血管壁逸出管外。以渗出为主要病变的炎症,称为渗出性炎症。渗出是致炎因子损伤作用的结果,也是机体抗损伤的防御功能的表现。
渗出过程中血管的改变致炎因子首先使小动脉短暂收缩,一般可持续数秒钟至数分钟,这可能是神经逆轴索反射(神经冲动不通过脊髓,而由受刺激组织的神经,直接反射到血管)的结果。小动脉短暂收缩后,由于炎症介质(如组胺、缓激肽等)的作用,小动脉发生扩张,前毛细血管括约肌松弛,致使更多的毛细血管开放(称毛细血管床增多),血液流入增多,因此受累的组织表现红、热,这称为动脉性充血。这时,由于局部血量增多,血管内液体静压升高,发生暂时性含少量蛋白质的液体成分漏出,导致局部组织肿胀。
动脉充血后,静脉端毛细血管及细静脉发生扩张,这称静脉性充血。这时小血管,特别是小静脉通透性增高,含蛋白质丰富的液体成分渗出血管外,血液浓缩粘度增高,血流迟缓(这称为淤滞)。
淤滞发生后,白细胞(主要是嗜中性白细胞)向血管内皮细胞靠拢、粘附(称为白细胞着边)。白细胞着边的机理尚不完全清楚,可能是由于:
(1)白细胞的粘性增高。实验已证明,轻微损伤的白细胞粘性是增高的;
(2)可能是受趋化因子(如C5a)的吸引;
(3)也可能是Ca2+成为带有负电荷的内皮细胞与白细胞的联接物;
(4)有人发现轻微损伤的内皮细胞粘附性增强,也可能是内皮细胞膜表面的粘多糖发生改变而致粘性增高。着边的白细胞以阿米巴运动的方式自毛细血管或细静脉内皮细胞间隙游出于血管外(逸出)。正常情况下两个内皮细胞间由粘合质粘合,在炎症介质作用下,内皮细胞胞内的肌动球蛋白收缩,使内皮细胞间隙增宽。如果内皮细胞基底膜受损害,则红细胞也可被动地在液体静压作用下,逸出血管外,这称为出血。
血液的液体成分既可从间隙渗出,也可通过内皮细胞本身渗出。人们观察到血液中液体与较小颗粒的分子,可通过泡饮作用进入内皮细胞浆,在胞浆中形成小泡,小泡相连并向基底膜方向移动,最后渗出于内皮细胞外(但这个观点尚未得到广泛的承认)。泡饮作用也可是正常时血液中的液体成分及蛋白质与内皮细胞外体液交换的途径。
与渗出有关的炎症介质炎症介质有两类,即神经源性介质和化学性介质。神经源性介质表现在小动脉的短暂性收缩。切断支配神经或预先给以麻醉药物,即可避免小动脉收缩现象。化学性介质的种类很多。与渗出有关的主要介质包括使小血管通透性增高的介质(血管活性胺、缓激肽、补体、白三烯)和使血管扩张的介质(如前列腺素)。
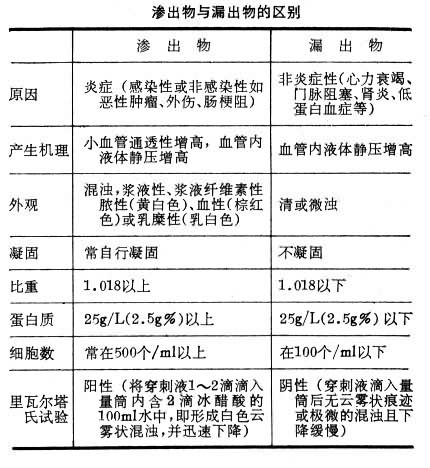
渗出物在炎症时,血液中的液体、蛋白质及血细胞渗出到血管外间质中或体腔中。渗出的物质称为渗出物,这说明小血管的通透性增高。有时血管中的液体成分,由于血管内液体静压升高而漏出血管(血管内皮细胞通透性正常),这种液体含蛋白质量少,称为漏出物。临床上见浆膜腔积液时,可用穿刺针取出少量液体检查并区别其为渗出物抑漏出物(见表)。
渗出是致炎因子造成的局部损伤作用,致炎因子导致血管扩张充血,管壁通透性增高,血管内的液体成分和细胞成分逸出管外。渗出又是机体对损伤作用产生的炎性防御反应,通过炎症的充血与渗出,组织获得更多的营养和抗体、补体及杀菌物质,稀释及消除有害刺激物,纤维素可限制细菌的蔓延,吞噬细胞吞噬及清除病原微生物、组织碎屑及异物。渗出也可能存在对机体不利的因素,比如胸腔或心包腔内渗出液过多可以压迫肺或心脏,影响它们的功能。所以应及时穿刺抽出过多的胸腔或心包腔内积液。