[拼音]:xuehong danbai he jihong danbai
[外文]:hemoglobin and myoglobin
两种以血红素为辅基并能与氧分子可逆结合的蛋白质。血红蛋白的功能是将大气中的氧输送给机体;肌红蛋白的功能则是贮存氧气,当机体需要时再释放。肌红蛋白存在于肌细胞中,从软体动物到人的各种动物中都有。血红蛋白主要存在于脊椎动物血液的红细胞中。酵母、草履虫、许多无脊椎动物也有血红蛋白。1945年中国科学家王应睐和英国科学家D.基林从豆科植物的根瘤中分离出了豆血红蛋白。
一级结构血红蛋白分子有两个α和两个β亚基,一般用α2β2表示。血红蛋白的分子量为64000,每个亚基的分子量为16000,其中α亚基含141个氨基酸残基,β亚基含146个氨基酸残基,α亚基的C端是精氨酸,β亚基的C端是组氨酸,人血红蛋白的α及β亚基的全部氨基酸顺序均已阐明。
血红蛋白的每个亚基都有一个辅基──血红素。血红素是一个由原卟啉分子与一个铁原子结合的化合物,所以又称铁卟啉。二价铁离子(Fe2+)的络合价(配位键)是6,与卟啉的4个氮原子络合后还剩下两价。在血红蛋白分子中,Fe2+的第五个络合价在α亚基中与87位的组氨酸中的咪唑基结合,在β亚基中与92位组氨酸结合。Fe2+的第六个络合价就是与氧分子(O2)结合的地方。因此血红蛋白的每个亚基可以结合一个O2,整个分子可结合 4个O2。血红蛋白在与O2结合前后,血红素中的Fe2+价态不变。当铁原子为二价或三价时相应的血红蛋白分别称为亚铁及正铁血红蛋白,正铁血红蛋白失去与氧结合的能力。与氧结合的血红蛋白称氧合血红蛋白,未与氧结合的血红蛋白称脱氧血红蛋白。
肌红蛋白分子由分子量约17000的一条肽链组成,含153 个氨基酸残基。每个肌红蛋白分子含有一个血红素辅基。 肌红蛋白的一级结构与血红蛋白的α亚基或β亚基极为相似。因此推想,它们是从同一个分子进化而来。
高级结构血红蛋白分子的α亚基和β亚基和肌红蛋白分子的二级和三级结构高度相似,即三者的螺旋与非螺旋结构成分的分布以及肽链的走向都非常相似(图1)。
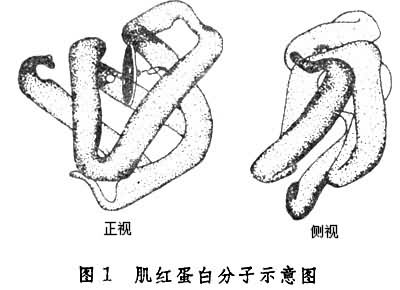
英国科学家 J.C.肯德鲁利用X射线晶体衍射技术阐明了肌红蛋白的立体结构,这是第一个阐明空间结构的蛋白质。整个肽链共有 8段α-螺旋。各段螺旋从N端起,依次标为A,B,C,D,…,H等。肌红蛋白中有80%的氨基酸残基处在α-螺旋区域,分子中没有β-折叠层,在肽链的拐曲处呈无规则卷曲。几乎所有的疏水残基均位于分子内部,因此靠近中心处的血红素处在一个疏水环境中,位于螺旋E和螺旋F之间的口袋里。血红素的铁原子的第五配位价与92位HiS络合,64位HiS处在Fe的第六配位价附近,中间的空隙就是氧结合的位置。大部分极性基团暴露于分子表面。
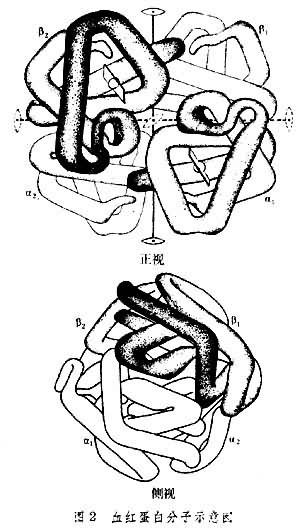
血红蛋白分子是一个近似于圆球的四面体,长、宽、高分别为64埃、55埃和50埃。四个亚基分别位于四面体的四个角上,相同的亚基位于对角线位置。亚基虽近似于球状,但相互之间凹凸正好相补。四个血红素的位置处在贴近分子表面的袋穴之中(图2)。
 与氧的结合
与氧的结合
血液中O2的饱和度指血红蛋白实际结合氧的数量与最大可能结合氧的数量的百分比,即
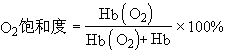
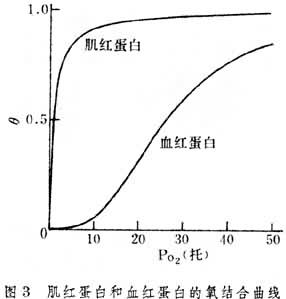
氧饱和度和大气内氧分压Po2之间的关系如图3所示,图中列出血红蛋白和肌红蛋白的氧饱和度曲线,也称氧结合或氧解离曲线。肌红蛋白的氧结合曲线呈双曲线,而血红蛋白呈S形曲线。 这是因为每个肌红蛋白分子仅有一个O2的结合位置,因此每一肌红蛋白分子和O2的结合均是独立的,和其他肌红蛋白分子无关。而血红蛋白分子是由四个亚基所组成,每一亚基均有一个O2的结合位置,血红蛋白分子对O2的结合是四个亚基的协同作用的结果。这也反映了两种蛋白质的生理功能是不同的。肌红蛋白的功能是储备氧,只有当剧烈活动时血液输氧不足以补偿肌肉消耗而致局部氧分压很低的情况下,才放出氧来应急。而血红蛋白的功能是运输氧,所以它既能在肺筛泡的高氧分压条件下充分结合氧,又能在周围组织的低氧分压条件下将大部分氧释放出来。
将血红蛋白与氧分子的结合写成下列平衡关系:
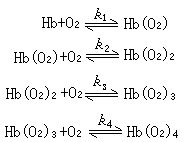
k是各亚基依次与氧结合的平衡常数。图3S 形曲线表明它们之间存在下列关系:
k1k2≈k3k4
这一关系表现为典型的正协同作用(见别构效应)。
大气中 CO2的分压或体内氢离子浓度升高导致pH的下降,可以降低血红蛋白结合氧的亲和力。这一现象称波尔效应,具有重要的生理意义,因为当血液流经周围组织时局部 CO2分压较高,促进氧合血红蛋白分子释放O2,生成的脱氧血红蛋白分子可与CO2结合。 当血液流经肺部时,CO2的释放促使脱氧血红蛋白与氧的亲和力增加,从而有更多的氧合血红蛋白生成。肌红蛋白则无此效应。
不同发育阶段的血红蛋白在大多数正常人的一生中可以合成 5种不同的亚基,即α、β、γ、δ、和ε。在正常成人的红细胞中含有两种类型的血红蛋白,一种是HbA,占总量96%以上,另一种HbA2,占1.5~4%,在人胎儿的红细胞中含有另外一种血红蛋白 HbF。这些血红蛋白的区别在于亚基组成的不同。它们均具有相同的两条α亚基,但另两条亚基构成不同。HbA是 α2β2,HbA2是α2δ2,HbF是α2γ2。HbF在新生儿的最初七个月中存在。上述几种血红蛋白都属于正常类型。虽然β、γ、δ亚基的一级结构相互有一些差异,但是它们的高级结构非常相似。在不同的发育阶段都能发挥相应要求的输氧功能。
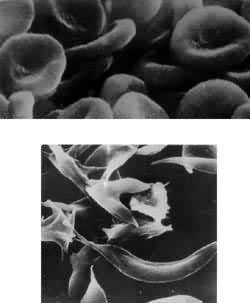
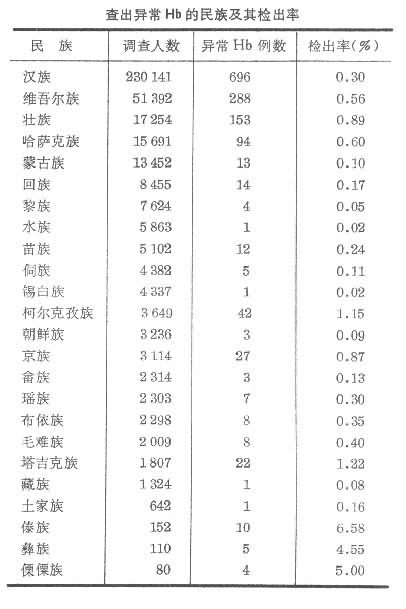
异常血红蛋白有些人携带的血红蛋白亚基与上述正常亚基的一级结构略有不同,引起了氧结合能力的异常,称为异常血红蛋白。到80年代初,已发现约400种异常血红蛋白。其中很多对携带者是无害的,但也有某些异常血红蛋白会引起致命的疾病,如导致镰刀状贫血症的血红蛋白就是一例(图4)。异常血红蛋白常可用电泳方法分离和鉴定。中国科学家从1980年开始至1982年底,在20个省市、自治区共调查了近60万人,总的异常血红蛋白检出率为0.29%(见表)。
到1983年止,中国已确定一级结构的异常血红蛋白共有32种,其中7种系世界上首次发现。
- 参考书目
- T.G.Traylor,Hemoprotein Oxygen Transportable Modelsand Mechanisms, in:E.E.Tamelen (ed.),Bioorganic Chemistry,Vol.Ⅱ, Academic Press, New York,1978.
- 全国血红蛋白病研究协作组:《20省、市、自治区60万人血红蛋白病调查》,中华医药杂志,1983/6,北京。