[拼音]:chendian
[外文]:precipitation
从液相中产生一个可分离的固相的过程,或指从过饱和溶液中析出的难溶物质。沉淀作用表示一个新的凝结相的形成过程,或由于加入沉淀剂使某些离子成为难溶化合物而沉积的过程。例如,以稀硫酸为沉淀剂滴加到钡盐溶液中,便可得到硫酸钡沉淀。产生沉淀的化学反应称为沉淀反应。
溶度积常数
物质的沉淀和溶解是一个平衡过程,通常用溶度积常数Ksp来判断难溶盐是沉淀还是溶解。溶度积常数是指在一定温度下,在难溶电解质的饱和溶液中,组成沉淀的各离子浓度的乘积为一常数。各种难溶盐有不同的溶解度,通过测定难溶盐在纯水中的溶解度,便可以算出溶度积。它决定了从溶液中可分离出组分的限度。以硫酸钡为例,如溶液中[Ba2+][SO娸]<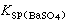 ,溶液处于不饱和状态时,肯定不会产生沉淀。如在此溶液中加入硫酸钡固体,它将会或多或少地溶解。在纯的硫酸钡饱和溶液中,[Ba2+][SO娸]=
,溶液处于不饱和状态时,肯定不会产生沉淀。如在此溶液中加入硫酸钡固体,它将会或多或少地溶解。在纯的硫酸钡饱和溶液中,[Ba2+][SO娸]=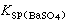 ,硫酸钡沉淀与溶液中的Ba2+、SO娸处于动态平衡,沉淀析出的速度与沉淀溶解的速度相等,且[Ba2+]=[SO娸]。此时若加入含SO娸的试剂,则Ba2+与SO娸 浓度的乘积便超过了溶度积[Ba2+][SO娸]>
,硫酸钡沉淀与溶液中的Ba2+、SO娸处于动态平衡,沉淀析出的速度与沉淀溶解的速度相等,且[Ba2+]=[SO娸]。此时若加入含SO娸的试剂,则Ba2+与SO娸 浓度的乘积便超过了溶度积[Ba2+][SO娸]>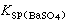 ,溶液处于过饱和状态,超过Ksp的部分便会以硫酸钡的形式析出,直到[Ba2+][SO娸]=Ksp为止。但此时[Ba2+]不再等于[SO娸],而是[Ba2+]《[SO娸],并且加入的SO娸越多,则[Ba2+]越小,反之亦然。但平衡时二者之积仍为一常数。分析化学上经常利用这一关系,以加入一种与组成沉淀相同的离子的办法,使另一种离子沉淀,直到留在溶液中的部分可以忽略为止。这种由于加入同离子而使沉淀溶解度降低的现象,称为同离子效应。
,溶液处于过饱和状态,超过Ksp的部分便会以硫酸钡的形式析出,直到[Ba2+][SO娸]=Ksp为止。但此时[Ba2+]不再等于[SO娸],而是[Ba2+]《[SO娸],并且加入的SO娸越多,则[Ba2+]越小,反之亦然。但平衡时二者之积仍为一常数。分析化学上经常利用这一关系,以加入一种与组成沉淀相同的离子的办法,使另一种离子沉淀,直到留在溶液中的部分可以忽略为止。这种由于加入同离子而使沉淀溶解度降低的现象,称为同离子效应。
沉淀的结构类型
可分为晶形沉淀和非晶形沉淀两大类。非晶形沉淀又称为无定形沉淀或胶状沉淀。如硫酸钡是典型的晶形沉淀,Fe2O3·nH2O是典型的非晶形沉淀。它们之间虽无绝对界限,但仍有明显差异。晶形沉淀颗粒大,直径约在0.1~1微米之间,内部排列较规则,结构紧密,易于沉降和过滤;非晶形沉淀颗粒很小,其直径通常小于0.02微米,没有明显的晶格,排列杂乱,结构疏松,体积庞大,易吸附杂质,难以过滤,也难以洗干净。
沉淀的形成过程很复杂,至今尚不完全了解沉淀形成的机理。实验证明,沉淀和颗粒的类型、大小,既取决于物质的本性,又取决于沉淀的条件。一般说来,沉淀本身的极性愈强、溶解度愈大,愈容易形成晶形沉淀,如PbSO4、BaSO4、MgNH4PO4·6H2O、CaC2O4·H2O等;而溶解度很小的 Al2O3·nH2O、Fe2O3·nH2O、金属硫化物、高价金属离子的水合氧化物等总是生成无定形沉淀。沉淀颗粒的大小与进行沉淀时构晶离子浓度的大小有关。例如从稀溶液中缓慢沉淀出的硫酸钡为晶形沉淀,颗粒也较大;而从浓溶液中析出的硫酸钡,颗粒十分细小,甚至可以是胶状沉淀。
沉淀条件
在实际工作中,必须根据不同的沉淀类型选择不同的沉淀条件,以获得合乎要求的沉淀。
(1)对于晶形沉淀,主要是创造条件以生成较大的晶粒,避免形成能穿透滤纸的微小结晶。例如要在热的稀溶液中,在搅拌下慢慢加入稀沉淀剂进行沉淀。沉淀以后,将沉淀与母液一起放置一段时间,以使不完整的晶粒转化为较完整的晶粒,小晶粒转化为大晶粒,这一过程称为“陈化”。加热和搅拌可以缩短陈化的时间。
(2)对于无定形沉淀,主要是加速沉淀微粒凝聚、防止形成胶体溶液,力争获得含水少、结构较紧密的沉淀。为此,要在热的浓溶液中进行沉淀,同时加入大量电解质促使沉淀凝聚,沉淀完毕立即过滤,不必陈化。
沉淀反应的应用
(1)定性分析,经典的定性分析中,一半以上的检出反应是沉淀反应。例如在Hg2+、Tl3+存在时,利用AgCl沉淀的生成检出Ag+,这个反应几乎是特效的;
(2)定量分析,利用沉淀反应可以进行重量分析,沉淀反应还是沉淀滴定法的基础,利用生成难溶的银盐,可以测定Cl-、Br-、I-、SCN-和Ag+等;
(3)分离方法,在分析化学中,常常利用沉淀反应将欲测组分分离出来,或将其他共存的干扰组分沉淀下来,然后用过滤或离心法将其分离除去,以消除干扰,提高测定的准确度。例如用草酸盐和氟化物沉淀法可将稀土元素与许多共存元素分离。在沉淀分离法中,采用有机沉淀剂是发展方向。有机沉淀剂具有选择性好、分子量大、获得的沉淀容易处理等优点。例如丁二肟是测定Ni2+的高选择性试剂。在含氨介质中,丁二肟与Ni2+生成红色的沉淀Ni(C4H7N2O2)2,它的组成恒定,溶解度很小,可以在110~120℃烘干后直接称量。也可以利用此沉淀反应使Ni2+与Co2+、Mn2+、Zn2+、Fe3+、Cr3+等分离。