[拼音]:gongzhenlun
[外文]:resonance theory
一种分子结构理论。适用于讨论一些不能以价键(见化学键)结构式进行描述的分子,如苯一类的芳香烃。共振论是20世纪30年代由L.C.鲍林提出来的。
规则
(1)当一个分子、离子或自由基的电子结构不能用一个价键结构(路易斯结构)式描述时,则它们的真实结构就是两个或多个路易斯结构式的混合体。这种结构又称为正则结构或极限结构。这种正则式并不存在,只是各种可能的正则结构彼此之间共振的一个杂化体。例如苯(上式)和碳酸根CO娫离子(下式):
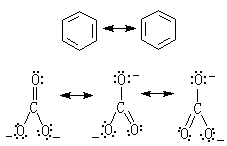
式中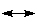 表示正则结构的共振。
表示正则结构的共振。
(2)在所有的正则式中只允许电子移动, 核的相对位置不变,如丙烯基正离子可写成:
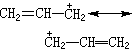
不能写成环状结构:
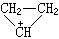
(3)所有的正则式必须是真正的路易斯结构如甲醇(左式)和萘(右式)的下列结构不符合路易斯结构规则,因碳是五价的:
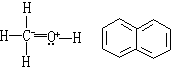
(4)一切正则式的未共享电子数必须相等。
(5)任何正则式的能量都大于实际分子的能量,共振能导致分子的稳定。
(6)一切正则式对实际分子的贡献不等,等价的(指起相同作用的)正则式贡献大;较稳定的正则式贡献也大,如下列正碳离子:
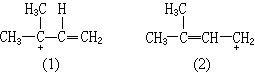
式(1)较式(2)稳定,所以式(1)贡献大。
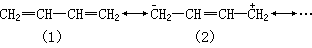
以式(1)为主,因式(1)有11个共价键,而式(2)有10个。
(8)在正则式中的所有原子如果都有完整的价电子层,则较稳定。如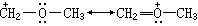 ,左式中的正碳原子为6个电子,而右式中的正氧原子为8个电子,故右式稳定。
,左式中的正碳原子为6个电子,而右式中的正氧原子为8个电子,故右式稳定。
(9)正则式所带的负电荷若位于电负性较大的原子上时,要比位于电负性较小原子上时稳定,如:
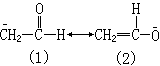
式(2)较式(1)稳定,因氧的电负性较大。
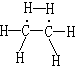
(10) 键角和键长有改变的结构不稳定,如乙烷的结构式如下:
应用
共振论主要用来阐明有机化合物的物理性质和化学性质。
物理性质方面(1)偶极矩,例如氯乙烷的偶极矩为2.05德拜,而氯乙烯为1.00德拜。其原因是氯乙烯有共振关系式:
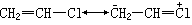
而后者的极性与前者相反,故偶极矩小一些。
(2)键长,已知C-C键长为1.54埃,C匉C键长为1.34埃,而苯分子中的所有C-C键均为1.39~1.40埃,说明苯分子的C-C键长偏于双键性质。
化学性质方面(1)推测反应位置,例如苯环上的亲电取代反应,氨基是邻、对位定位基,而硝基是间位定位基:
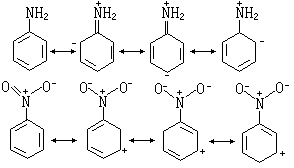
(2)说明有机化合物的酸碱性顺序,例如羧酸>酚>醇。这种酸性顺序难以用诱导效应来解释,用共振结构式则可得满意解释。因为羧酸分子有如下共振,易于失去氢:
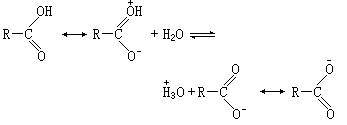
而醇分子不能形成羟基氧原子上带有正电荷的共振结构式。在苯酚中可以有共振结构式存在,使羟基氧原子带有正电荷,易于放出氢原子,所生成的酚氧离子又可有如下的共振结构式:
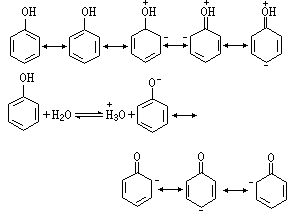
由于酚氧离子的负电荷分散到整个分子中,故较稳定。但这种共振结构式是不等价的,负电荷在碳原子上较不稳定,故苯酚的酸性小于羧酸,大于醇。
共振论是一种定性的经验理论,对有些化合物不适用,如在解释下列化合物时,会得出错误结论。
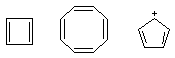
此外,共振论不能说明立体化学问题。因此在使用共振论的规则时,在个别的情形下,要从各个角度考虑。
- 参考书目
- T. W. G. Solomons, Organic Chemistry,2nd ed., John Wiley & Sons, New York, 1980.