[拼音]:jinshu fushi
[外文]:corrosion of metals
金属与周围环境的化学和电化学作用而产生的损坏。金属发生腐蚀必须有外部介质(即环境)的作用,而且该作用发生在金属与介质的界面上。金属腐蚀不包括因单纯机械作用引起的金属磨损破坏。“腐蚀”这个术语起源于拉丁文“corrdere“,意即“损坏”、“腐蚀”。20世纪50年代前,腐蚀的定义只局限于金属的腐蚀,但是随着非金属材料(例如陶瓷、塑料、橡胶等等)的迅速发展,从50年代起,腐蚀的定义趋向于扩大到所有的材料。英国著名的腐蚀科学家U.R.伊文思在20年代前后开始研究金属腐蚀理论,他与他的学生在这方面的研究工作奠定了腐蚀学科的基础。
金属腐蚀是一种社会公害。估计全世界每年因腐蚀报废的钢铁设备约相当于年产量的30%。据1980年估算,中国因金属腐蚀造成的损失,每年多达100~150亿元。虽然腐蚀不可避免,但可以通过腐蚀科学和腐蚀工程技术,防止或减少腐蚀的危害。
分类根据腐蚀的机理,金属腐蚀可分为①化学腐蚀,指金属表面与非电解质直接发生化学作用而引起的破坏,如金属在高温下的腐蚀;
(2)电化学腐蚀,指金属表面与离子导电的介质因发生电化学作用而产生的破坏,这是大多数金属腐蚀的起因;
(3)物理腐蚀,指金属由于单纯的溶解所引起的破坏,如金属溶于汞中。按照受腐蚀金属的形态,可将金属腐蚀分为:
(1)全面腐蚀,指腐蚀分布在整个金属表面上,它一般为均匀腐蚀,例如碳钢在强酸中的腐蚀;
(2)局部腐蚀,指腐蚀主要集中于表面某些区域,而表面的其他部分则几乎未被破坏。
常见的局部腐蚀有:
(1)电偶腐蚀,即异种金属在同一介质中接触,由于不同金属的电势不相等而有电偶电流流动,使电势较低的金属在接触处局部腐蚀,它也称双金属腐蚀或接触腐蚀。
(2)小孔腐蚀,即在金属表面的局部地区,出现向深处发展的腐蚀小孔,如不锈钢和铝合金在含氯离子介质中常出现这种腐蚀,它简称孔蚀或点蚀。
(3)缝隙腐蚀,即金属部件间若存在缝隙,缝隙内介质处于静止和缺氧状态,从而引起缝内金属加速腐蚀。
(4)晶间腐蚀,即腐蚀沿着金属或合金的晶粒边界或它的邻近区域发展,晶粒本身腐蚀很轻微。
(5)应力腐蚀破裂,指金属材料在固定拉应力和特定介质的共同作用下所引起的破裂,如碳钢、低合金钢在含硫化氢的溶液或海水里均可发生应力腐蚀破裂,简称应力腐蚀,是所有腐蚀类型中危害最大、经常导致突然事故的一种腐蚀。
(6)腐蚀疲劳,指金属在循环应力或脉动应力和腐蚀介质的联合作用下引起的腐蚀。
(7)磨损腐蚀,指由于介质与金属构件相对运动速度大,导致构件表面遭受严重的腐蚀损坏,简称磨蚀。高速流体引起的磨蚀有湍流腐蚀和空泡腐蚀两种。
(8)选择性腐蚀,合金在腐蚀介质中不是按合金的比例侵蚀,而是发生了其中某种成分的选择性溶解,如黄铜管在海水中脱锌。
(9)细菌腐蚀,指细菌生命活动的结果间接对金属腐蚀的电化学过程产生影响,腐蚀部位总带有孔蚀的迹象。
(10)氢损伤,金属由于有氢存在,与氢反应引起的机械破坏,它常常由于腐蚀介质作用的结果而间接发生。有四种不同类型:氢脆和氢鼓泡是由于因氢原子渗入金属内部,产生机械破坏作用;脱碳和氢蚀是高温下氢的作用引起。
机理金属发生腐蚀的原因在于金属与周围介质构成一个热力学上不稳定的体系,该体系有从不稳定趋于稳定的倾向。这种倾向的大小可以通过恒温恒压下腐蚀过程自由吉布斯函数变化(ΔG)T,p来衡量。如果(ΔG)T,p<0,则腐蚀过程可能发生,且 (ΔG)T,p 愈负,一般表示金属愈不稳定;如果 (ΔG)T,p >0, 则腐蚀过程不可能发生,且(ΔG)T,p愈正,通常表示金属愈稳定。大多数金属腐蚀的本质是电化学的氧化还原反应。伴随一个电化学反应的自由吉布斯函数变化可按ΔG=-nFE计算,式中n为反应中电子转移数;E为该电化学反应所决定的可逆电池的电动势;F为法拉第常数。电化学反应可分割为两个电极反应,各个电极的平衡电势由能斯脱公式计算,金属元素的电极电势可用作粗略地判断金属腐蚀倾向的依据。若金属的标准电极电势比介质中某一氧化性物质的标准电极电势为负,从而构成了腐蚀电池,金属将有被该物质氧化或腐蚀的倾向;反之,便不可能发生腐蚀。电极平衡电势与溶液的浓度和酸度存在着一定的函数关系,据此, 比利时学者 M.布拜提出了电势-pH图(也称布拜图),图上各条线代表一系列的等温等浓度的电势-pH线。电势-pH图是一种电化学的平衡图,借助它可以从理论上预测金属的腐蚀倾向和选择控制腐蚀的途径。图1
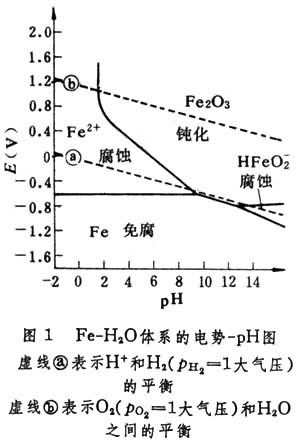
是简化的Fe-H2O体系的电势-pH图。图中每一条线代表固相与溶液或固相与固相之间的平衡,这些线把Fe-H2O体系的电势-pH图分成三种区域:
(1)腐蚀区, 该区内处于稳定状态的是可溶性 Fe2+、Fe3+、HFeO娛等离子,故有腐蚀铁的倾向;
(2)免腐区,金属处于热力学稳定状态,故不腐蚀;
(3)钝化区,该区内由于具有保护性氧化膜而处于热力学稳定状态,腐蚀速率大大降低,故金属腐蚀不明显。代表氢从水中析出反应的平衡线嘙和代表氧与水的平衡线嘜在整个pH的范围内都位于Fe的稳定区之上, 这意味着铁在水溶液中所有的pH范围内, 根据热力学原则都可发生腐蚀并伴随有氢气析出或氧被还原。
金属的腐蚀是一种自发的氧化过程,必须同时存在着某一氧化性物质的还原过程,而且氧化和还原过程的反应速率必须相等,体系方达稳定。这一对氧化和还原过程称共轭过程,即金属腐蚀电池中实际发生的阳极和阴极过程。例如铁在稀硫酸中被腐蚀时产生氢气:
Fe+2H+─→Fe2++H2 (1)
式(1)可分解为:
Fe─→Fe2++2e (2)
2H++2e─→H2 (3)
式(2)和(3)就是一对共轭过程,式(2)表示铁的腐蚀(氧化);式(3)表示氧化性物质H+被还原的过程。在中性介质内,H+很少,铁的腐蚀主要是由从空气中溶解的氧引起的:
2H2O+O2+4e─→4OH-
此时铁的氧化和氧的还原构成了共轭过程。
图2
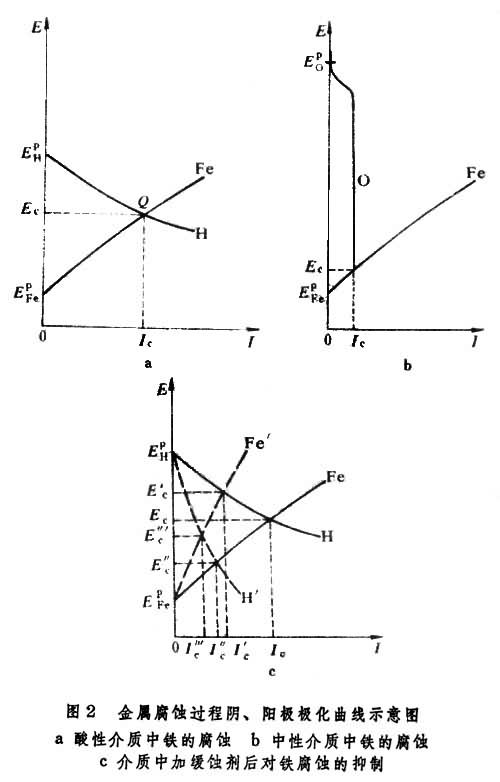
是腐蚀电池内极化曲线示意图,称为伊文思图。
图2a的Fe线表示Fe的阳极极化曲线,它的起点E坔代表铁在介质中的平衡电势,此时电流为零。H线表示H+阴极还原的极化曲线, 它的起点E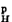 表示H+│H2的平衡电势。两条线的交点Q 代表这两个反应的速率相等,满足了共轭过程的条件,故Q点的电流是铁在酸性介质中的自腐蚀电流Ic,即铁的腐蚀速率。Q点的电势称为自腐蚀电势Ec,它是可以直接测量的(相对于某个参比电极),Ec在E坔和E
表示H+│H2的平衡电势。两条线的交点Q 代表这两个反应的速率相等,满足了共轭过程的条件,故Q点的电流是铁在酸性介质中的自腐蚀电流Ic,即铁的腐蚀速率。Q点的电势称为自腐蚀电势Ec,它是可以直接测量的(相对于某个参比电极),Ec在E坔和E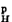 之间,所以也称混合电势或静态电势。I虽不能直接测量,但是可以根据金属腐蚀的电化学理论推算出来。
之间,所以也称混合电势或静态电势。I虽不能直接测量,但是可以根据金属腐蚀的电化学理论推算出来。
图2b是以氧为共轭阴极过程的铁在中性介质内的腐蚀过程示意图。氧的平衡电势虽然比E坔正得多,但由于氧在水中的溶解度很小,它的阴极还原极化曲线(O线)存在着极限电流(见扩散超电势),故它的Ic比铁在酸性介质中的Ic(图2a)小得多。
为了抑制铁在酸性介质中的腐蚀,常常需要加入少量缓蚀剂,其作用可以是抑制腐蚀的阳极过程,即增加阳极过程的极化(图2c的Fe′线),从而使Ic减小到I婞;其作用也可以是抑制阴极过程(图的H′线),同样产生I幝减小的效果。前者称为阳极型缓蚀剂;后者称为阴极型缓蚀剂,两者都可以从Ec改变的方向进行判别。有些效果很好的缓蚀剂对自腐蚀电势E幟(很接近Ec)没有多大影响,但自腐蚀电流I幟变得很小,这是由于它同时抑制阴极和阳极过程的缘故。
伊文思图中的极化曲线只是示意,并非实际的极化曲线,但是比较简明,对于理解各种腐蚀过程很有帮助。
腐蚀速率的测定方法经典的失重法测定金属在一段时间内的平均失重。失重法准确,但周期长;电化学方法迅速、简便,方法是测量Ic,或与Ic成比例的电物理量(如腐蚀电阻)。常用的有:塔费尔直线外推法、M.斯特恩和A.L.吉尔里等建立的线性极化法以及弱极化区的极化测量法。许多表面形貌分析、表面成分分析和现场电化学光学技术,已广泛地应用于腐蚀研究。
腐蚀的控制研究金属腐蚀的最终目的在于有效地控制腐蚀,常用的技术有:
(1)合理选材;
(2)阴极保护,将被保护金属外加阴极极化以降低或防止腐蚀,阴极保护可采用外加阴极电流和牺牲阳极两种方法(如海水中船体和码头的阴极保护);
(3)阳极保护,对易钝化金属可采用外加阳极电流的办法,使金属处在钝化区以降低腐蚀;
(4)介质处理,包括去除介质中的有害成分,调节pH值(如锅炉水处理)和改变湿度等;
(5)添加缓蚀剂;
(6)金属表面加覆盖层,在金属表面喷、衬、渗、镀、涂上一层耐蚀性较好的金属或非金属物质或将金属进行磷化和氧化处理,使被保护金属表面与介质机械隔离而降低金属腐蚀;
(7)合理的防腐设计和改进生产工艺流程。
70年代发展起来的表面修饰技术为金属腐蚀的防护开辟了新途径,主要已采用两种技术:
(1)激光表面熔融技术,用强功率短脉冲激光使金属表面熔化,接着将热传导到体相,使金属表面迅速淬火,形成耐蚀的均匀表面层;
(2)离子注入技术,先使能促进金属耐蚀的元素离子化,再将它们注入金属表面层,这样既改变表面层成分,又改变表面层的缺陷结构,甚至可使其无定形化,以提高耐蚀能力。
金属腐蚀虽然有害,但也可加以利用,例如电化学加工正是利用受控制金属快速腐蚀来加工金属零件的。