[拼音]:luohe didingfa
[外文]:complexometric titration
又称螯合滴定法。是以络合反应(见配位化学)为基础的容量分析方法,它主要以氨羧络合剂为滴定剂,较常用氨羧络合剂有氨三乙酸(NTA)、乙二胺四乙酸(EDTA)、环己烷二胺四乙酸(DCTA)、三乙四胺五乙酸(DTPA)、乙二醇二乙醚二胺四乙酸(EGTA)。这些氨羧络合剂对许多金属有很强的络合能力,在碱性介质中能与钙和镁化合成为易溶而又难于离解的络合物。瑞士的G.K.施瓦岑巴赫及其合作者详细研究了它们的化学性质,并于1945年首先提出用EDTA二钠盐滴定钙和镁以及测定水的硬度(见彩图),奠定了络合滴定法的基础。在络合滴定中大约95%以上的滴定是用EDTA二钠盐进行的。


EDTA络合物及其稳定性
EDTA的阴离子Y4-与金属离子Mn+按1∶1络合,其反应为:
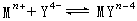 (1)
(1)
其稳定常数为:
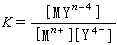 (2)
(2)
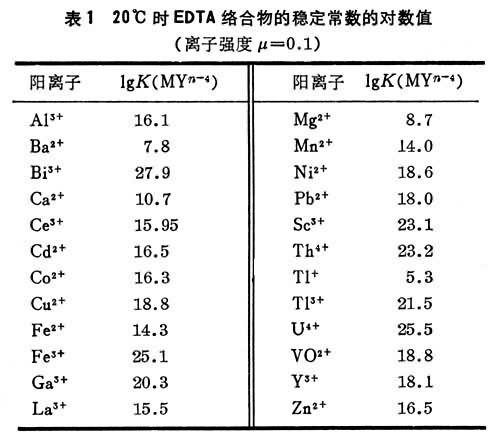
式中[MYn+-4]为金属络合物的浓度;[Mn+]和[Y4-]为平衡时未络合的金属离子和EDTA阴离子Y4-的浓度。大多数络合物的稳定常数已测定(表1)。K值愈大,稳定性愈高。
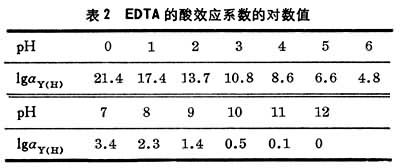
式(1)指出,EDTA离解为四价阴离子Y4-后才与金属络合;只有在pH≥12时才完全以Y4-存在。在较低的pH下,未络合的EDTA的总浓度 [Y′]应等于[Y4-]、[HY3-]、[H2Y2-]、[H3Y3-]、[H4Y]之和。因此,在一定pH下未络合的EDTA的总浓度[Y′]与四价阴离子的浓度[Y4-]有一定的比值关系,此比值称为酸效应系数αY(H):
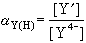 (3)
(3)
αY(H)可以根据下式求得:
αY(H)=[H+]K1+[H+]2K1K2+[H+]3K1K2K3+[H+]4K1K2K3K4 (4)
式中K1、K2、K3、K4分别为EDTA质子络合物的各级酸度常数,即EDTA的各级离解常数的倒数。EDTA的酸效应系数见表2。EDTA络合物的稳定性受酸度的影响,在一定pH下,其平衡常数应为:
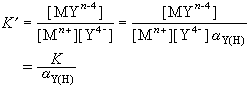 (5)
(5)
lgK′=lgK-lgαY(H) (6)
式中K′为取决于酸效应的表观稳定常数。例如,在pH=2时,Fe(Ⅲ)-EDTA络合物的lgK′=11.4,而Cu-EDTA的lgK′为5.1。酸度愈高,络合物的稳定性愈低。以金属的浓度为0.01Μ和滴定误差为0.1%时为例,要求lgK′≥8,才能为EDTA准确滴定。上例说明,在pH=2时,EDTA可以准确滴定铁(Ⅲ)而不能滴定铜。据此也可以确定滴定每一金属的pH范围:
第一组:pH=1~3(lgK>20)者,有 Zr、Th、Bi、Fe(Ⅲ)、Ga、In、Hg等。
第二组:pH=4~6(lgK=15~18)者,有铝、稀土元素、二价过渡金属等。
第三组:pH=10~12(lgK=8~11)者,有镁、碱土金属。
滴定第一组金属时,第二和第三组的金属原则上不干扰;滴定第二组金属时,第三组不会干扰;同组之间的金属相互干扰。故利用酸效应以提高滴定的选择性是有限度的,必须采取有效办法,如使用隐蔽剂或分离手段以消除干扰。
当两种金属MⅠ和MⅡ共存时,如果K >108,而且[MⅡ]=0.01Μ和(K
>108,而且[MⅡ]=0.01Μ和(K -K
-K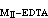 )>106,则可先滴定MⅠ而不受MⅡ干扰,继之可滴定MⅡ。例如,在pH2.5下滴定钍后,继续调节至pH=5~6,可滴定锌或铅。
)>106,则可先滴定MⅠ而不受MⅡ干扰,继之可滴定MⅡ。例如,在pH2.5下滴定钍后,继续调节至pH=5~6,可滴定锌或铅。
滴定方法
直接滴定用标准EDTA溶液直接滴定金属,以一适当指示剂确定终点。由于反应过程释放出氢离子,须使用缓冲溶液以维持pH恒定。有些金属在控制的pH下会水解,须加入一辅助络合剂以抑制之。例如,在pH=10时滴定铜、镍或锌等,可加入氨水防止水解,再用铬黑T为指示剂进行滴定。
回滴法某些金属容易水解或与EDTA络合缓慢,或者直接滴定没有适当的指示剂,可加入过量EDTA,然后用一适当金属回滴。例如,铝离子容易聚合而又与EDTA络合缓慢,经常用回滴法测定。
置换滴定在缺乏适当指示剂或在滴定条件下金属会水解而不能直接滴定时,除采用回滴法外,也可用置换滴定。置换反应为:
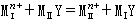
式中MⅠ为欲测定的金属,要求K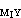 >K
>K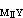 >108,使MⅠ能定量置换MⅡ而为EDTA滴定,从而间接求出MⅠ。例如,在有酒石酸的铅溶液中调至pH=10,加入过量的Mg-EDTA络合物,置换出与铅相当的镁,可用EDTA滴定而间接测得铅。另一种置换滴定法是用一种比 EDTA更强的络合剂HnZ置换MⅠ-EDTA络合物中的EDTA,用MⅡ滴定:
>108,使MⅠ能定量置换MⅡ而为EDTA滴定,从而间接求出MⅠ。例如,在有酒石酸的铅溶液中调至pH=10,加入过量的Mg-EDTA络合物,置换出与铅相当的镁,可用EDTA滴定而间接测得铅。另一种置换滴定法是用一种比 EDTA更强的络合剂HnZ置换MⅠ-EDTA络合物中的EDTA,用MⅡ滴定:
MⅠY+Zn+=MⅠZ+Yn+ (7)
最常用的方法是以氟化铵置换Al-EDTA中的EDTA,用铅或锌滴定而间接测定铝。
间接滴定主要用于滴定那些与 EDTA 弱络合的阳离子或不与 EDTA 络合的阴离子。例如,在含铍的碱性碳酸铵溶液中加入氯化六氨合钴(Ⅲ),生成橙色沉淀[Co(NH3)6][(H2O)Be(CO3)(OH)3·3H2O],将沉淀滤出,溶解后用EDTA滴定钴而测得铍。磷酸根可以沉淀成磷酸铋,加入过量的铋后用EDTA滴定而间接测得磷。
金属指示剂
容量分析以目视法确定终点必须借助指示剂来完成,络合滴定法不能例外。本法所用的指示剂要能与金属络合后呈相当深的颜色,络合物的lgK>5才有足够的灵敏度。指示剂络合物的稳定性要比EDTA络合物的稳定性约低3个lgK单位,终点才敏锐。此外,在同一pH下游离指示剂与指示剂络合物有显著不同的颜色,以使终点突变明显。此类指示剂称为金属(显色)指示剂。如果它能产生荧光,则称为金属荧光指示剂。铬黑T是滴定镁的良好指示剂,在pH=10时呈纯蓝色,与镁络合呈红色,其lgK′为5.4,故相当灵敏。在此pH下Mg-EDTA络合物的lgK′=8.2,大于Mg-铬黑T的lgK′(2.8),故易为EDTA夺取与指示剂结合的镁,终点敏锐,从红变为蓝色。铬黑 T与铜、镍、铁、铝等形成比EDTA更稳定的络合物,不能用作那些金属离子的指示剂。如滴定镁时有痕量的上述金属存在,则产生所谓封闭作用,阻塞了终点,可加入少量氰化钾以消除。金属指示剂除少数是无机化合物外,大都是有机化合物。已提出的指示剂为数不少,但用于实际工作中只有二、三十种(表3)。

除用金属指示剂确定终点外,也可使用仪器确定终点,如电位分析法、库仑滴定法、安培滴定法、紫外-可见分光光度法等,既可提高灵敏度和准确度,也可用于测定微量元素。
隐蔽剂
当MⅠ和MⅡ的lgK值相差不大(小于6)时,要使用隐蔽剂(见隐蔽和解蔽)隐蔽MⅠ或MⅡ,才能滴定MⅡ或MⅠ。作为隐蔽剂必须具备下列性质:
(1)隐蔽剂与干扰离子的络合物必须比EDTA更稳定;
(2)与干扰离子生成无色或浅色的可溶性络合物,加入后溶液清晰,不影响终点判断,也不太变动溶液的pH;
(3)不降低EDTA络合物的稳定性。络合滴定法中常用的隐蔽剂列于表4。
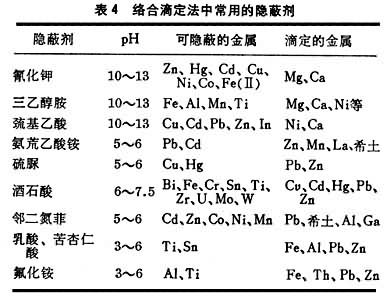
应用实例
自络合滴定法提出后,许多原材料的分析大为简化,例如测定硅酸盐、石灰石、炉渣中的钙和镁。方法是在含钙、镁的溶液中加入三乙醇胺以隐蔽铁、铝、钛和锰后,在pH=12时,以钙试剂为指示剂,用EDTA滴定钙;另取一份溶液,以三乙醇胺隐蔽铁等后在pH=10时以铬黑 T为指示剂,滴定钙镁合量,两者之差为镁量。利用EGTA与镁络合很弱(lgK只有5.2)的特点,在pH=13时以钙黄绿素为指示剂,用EGTA滴定钙至荧光消失,镁不干扰。取另一份溶液,加入EGTA隐蔽钙,调至pH=10,以甲基百里酚蓝为指示剂,用DCTA滴定镁。钍的浓度不超过 5×10-3Μ时,可在pH=2.8时以邻苯二酚紫为指示剂,用EDTA滴定至黄色终点,稀土元素不干扰。滴定钍后,不能继续调至pH=5.5再用 EDTA滴定稀土(用二甲酚橙也是如此),因此时微量钍会水解,与指示剂络合呈微红色,阻塞终点。如改用DTPA为滴定剂,则滴定钍后可继续滴定稀土,因DTPA络合钍较稳定,调至pH=5.5时,Th-DTPA络合物中的钍不会水解。氟化钾能隐蔽钛和铝,而苦杏仁酸只隐蔽钛。在pH=5.5下以氟化铵置换滴定铝时,如先加入苦杏仁酸隐蔽钛,则可迅速测定铝矾土、硅酸盐中的铝。硫脲在pH=5~6时能隐蔽汞,如用以置换络合汞的EDTA而作汞的间接滴定,则铜、银、锰、镉、铁、铋、铝、锌、钴、镍等不干扰,选择性极高。
- 参考书目