[拼音]:peiwei huaxue
[外文]:coordination chemistry
研究金属的原子或离子与无机、有机的离子或分子相互反应形成配位化合物(简称配合物)的特点以及它们的成键、结构、反应、分类和制备的学科。例如,[Fe(CO)5]、[Cu(NH3)4]2+和[Ni(CN)4]2-这三种配合物,分别由起中心作用的原子Fe或离子 Cu2+和Ni2+(统称中心原子)与围绕它们的称为配体的分子CO、NH3或离子CN-所组成。配合物在溶液中会发生离解,但仍保持其本体。配合物的电荷可以是正、零或负,由中心原子和配体所带电荷决定。在中心原子周围的配体总数称为配位数。
简史
最早有记载的配合物是18世纪初用作颜料的普鲁士蓝, 化学式为 K[FeⅡ(CN)6FeⅢ] 。1798年发现CoCl3·6NH3。CoCl3和NH3都是稳定的化合物,在它们结合成新的化合物后,其性质与组分化合物不同。这一发现开创了配位化学的研究。
19世纪就发现了更多的钴氨配合物和其他配合物。1893年瑞士化学家A.韦尔纳首先提出这类化合物的正确化学式及配位理论。他在配合物中引进副价的概念,提出元素在主价以外还有副价。例如,在一系列铂(Ⅳ)的配合物中铂的主价为+4,副价为+6,由此可解释这些铂配合物的存在和离解(表 1)。生成的离子数目由溶液电导和游离氯离子的分析确定。由于韦尔纳的出色工作,他于1913年获得诺贝尔化学奖。

配位键
解释配位键的理论有三种,即价键理论、晶体场理论和分子轨道理论。
价键理论主要是由L.C.鲍林发展起来的。该理论认为配合物是在路易斯碱(配体)和路易斯酸(金属或金属离子)之间反应生成(见酸碱理论),在配体和金属之间有配位键生成(不必全是配位键)。配体上的电子对转到金属的杂化原子轨道上。
晶体场理论认为金属-配体键是由点电荷之间的反应生成,把配体看作点电荷或偶极子,因而影响金属离子的部分已占的d轨道能量,并用来说明其成键结构。
分子轨道理论认为电子围绕整个配合物体系的分子轨道运动,它综合了价键和晶体场理论,是当前用得最广泛的理论。
配合物的稳定性
与金属离子和配体有关。由于配合物的生成主要是在荷正电的金属离子和配体阴离子或偶极分子之间进行的,金属离子的离子势(阳离子电荷与其半径之比)愈大,相同配体的配合物愈稳定。配合物的稳定性还与配体阴离子的可极化性有关。在一定限度内,阴离子的可极化性愈大,配体也愈易成为电子给体。例如,对于第四周期从Mn2+到Zn2+的二价金属离子,其配合物稳定性按F<O<N>S>P次序变化。对于d8或d10结构的贵金属,其配合物的稳定性,按P>S》N>O>F《Cl<Br<I的次序变化。
影响配合物稳定性的还有螯合作用,即双齿以上的配体在多于一个的位置上与金属离子连接成环。通常,螯合程度增加时,配合物的稳定性也就增加,例如乙二胺配合物的稳定性要比氨配合物大。
配合物的类型
按中心原子分类有单核配合物和多核配合物;按配体分类,常见的有水合配合物、卤合配合物、氨配合物、氰配合物、金属羰基合物等;按成键类型分类有经典配合物(σ 配键)、簇状配合物(金属-金属键)、烯烃等不饱和配体的配合物(π-σ键和π-π*反馈键)、铁茂等夹心、穴状、笼状配合物(离域共轭配键)等;按学科类型分类有无机配合物、有机金属化合物、生物无机化合物等。各种分类之间又有交叉。
水合配合物简称水合物。为金属离子与水分子形成的配合物。几乎所有金属离子在水溶液中均可形成水合配合物,例如[Cu(H2O)4]2+和[Cr(H2O)6]3+,常见的配位数是4和6。当其他配体加到金属离子水溶液中时,发生对水的置换作用,生成其他配合物。在这些置换反应中,金属的配位数一般保持不变。但并不总是如此,例如,将CN-离子加到含有[Ni(H2O)6]2+的水溶液中,最后生成[Ni(CN)4]2-和[Ni(CN)5]3-;将Cl-离子加到[Fe(H2O)6]3+中可产生[FeCl4]-等。
卤合配合物金属离子与卤素(氟、氯、溴、碘)离子形成的配合物。绝大多数金属离子均可生成卤合配合物,例如K2[PtCl4]和Na3[AlF6]。卤合配合物的稳定性变化范围很大,可按软硬酸碱理论的概念把金属离子和配体分类。金属离子分成硬酸和软酸。硬酸是指那些体积小、电荷高和没有容易变形或移动的价壳层电子的金属离子,例如Be2+、Mg2+、Al3+、Sc3+、La3+、Cr3+、Co3+和Fe3+等;软酸是指那些体积大、电荷低和具有容易变形或移动的价壳层电子的金属离子,例如Cu+、Ag+、Au+、Cd2+、Hg2+、Pd2+和Pt2+等。配体也可分为不易被极化的硬碱和易被极化的软碱,卤素中的F-和Cl-为硬碱,I-为软碱,Br-则介于二者之间。硬酸容易与硬碱结合,软酸容易与软碱结合。
硬酸类金属的卤合配合物在水溶液中的稳定性是按I<Br<Cl《F的次序递增,软酸类金属卤合配合物的稳定性则按F《Cl<Br<I的次序递增。
金属羰基合物为金属与一氧化碳结合的产物。在金属羰基合物中金属的氧化态都很低,有的羰基合物中金属氧化态为零,如Ni(CO)4;有的呈负氧化态的,如Na[Co(CO)4];有的呈正氧化态,如[Mn(CO)5Br]。这些都是单核羰基合物。还有多核金属羰基合物,如Fe2(CO)9和Fe3(CO)12(见羰基金属)。
簇状配合物即簇状化合物。含有至少两个金属,并含金属-金属键的配合物,例如Fe3(CO)12、Co4(C5H5)4H4、(W6Cl12)Cl6等。能够生成簇状化合物的金属主要是过渡金属(见过渡元素),它们的生成趋势与该金属在周期表中的位置、氧化态以及配体性质等条件有关。一般地说,第一过渡系的元素形成簇状配合物的能力比相应的第二、第三过渡系元素差。在同种元素中,低氧化态的容易形成簇状配合物(见原子簇金属化合物)。
有机金属化合物或称金属有机化合物,为有机基团与金属之间生成碳-金属键的化合物。许多有机金属化合物往往以配合物的形式存在,这种配合物有两种类型:
(1)金属与碳直接键合的σ 键(见共价键)有机金属化合物,包括烷基金属[如(CH3)6Al2]、芳基金属(如C6H5HgCl)、乙炔基金属(如HC呏C─Ag)等类化合物。大多数这类化合物,除有机配体外还可含有其他配体,例如CO、CN-、PR3(R为烷基)等;
(2)π键有机金属化合物,包括烯烃、炔烃、芳烃、环戊二烯基等配合物,例如蔡斯盐K[PtCl2(C2H4)],其结构如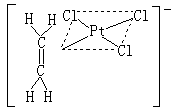 。在Pt和CH2=CH2之间是π-σ及π-π*键合。后又陆续制得银、铜、钯、钌等其他金属离子的烯烃配合物。又如二茂铁(C5H5)2Fe(见结构式a
。在Pt和CH2=CH2之间是π-σ及π-π*键合。后又陆续制得银、铜、钯、钌等其他金属离子的烯烃配合物。又如二茂铁(C5H5)2Fe(见结构式a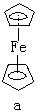 ),金属原子被夹在两个平行的碳环体系之间,称为夹心化合物。除了环戊二烯基外,还有其他不饱和环状配体的夹心化合物,如二苯铬(C6H5)2Cr(b)。生成夹心化合物的元素,主要是过渡元素中的第Ⅳ到第Ⅶ副族元素和除铂以外的第Ⅷ族元素,以及镧系元素和锕系元素(见金属有机物的键型)。
),金属原子被夹在两个平行的碳环体系之间,称为夹心化合物。除了环戊二烯基外,还有其他不饱和环状配体的夹心化合物,如二苯铬(C6H5)2Cr(b)。生成夹心化合物的元素,主要是过渡元素中的第Ⅳ到第Ⅶ副族元素和除铂以外的第Ⅷ族元素,以及镧系元素和锕系元素(见金属有机物的键型)。
生物配体与金属的配合物。它们在生物体中含量虽然不多,但在一系列有机体的生命活动中具有很重要的作用。多种金属蛋白质是金属酶,常能催化某种反应,例如含锌的碳酸酐酶可催化二氧化碳水合反应或其逆反应;含铁蛋白质(肌红蛋白、血红蛋白和蚯蚓血红蛋白)、含铜蛋白质(血青肌)和含钒蛋白质(血钒蛋白)能贮存和输送氧。其他重要的生物无机配合物还有叶绿素、维生素B12等(见生物无机化学)。
配合物的制法
许多配合物可由其组成化合物直接加成制得,例如由气相的BF3和NH3反应制备[F3B·NH3]。
由一种配体取代另一种配体,也是常用的一种制备配合物的方法。例如用乙二胺置换[Co(NO2)6]3-中的硝基,得到顺式-[Co(en)2(NO2)2]+(en为乙二胺)。
当金属离子具有不同氧化态时,可用氧化还原反应制备不同价态金属的配合物。高氧化态金属离子配合物,有时可在氧化剂存在下,由配体与低氧化态金属离子作用制得。例如在空气或氧存在下,氨与钴(Ⅱ)盐水溶液作用,生成钴(Ⅲ)氨配合物。低氧化态金属离子配合物,有时可在还原剂存在下,由配体与高氧化态金属盐作用制得。例如由CoCO3和H2及CO反应制备Co2(CO)8,H2是还原剂,CO是配体兼还原剂。
利用热分解方法,通过有控制地加热一些配合物可制得另一些配合物,例如加热 [Cr(en)3]Cl3可以制得顺式-[Cr(en)2Cl2]Cl。
配合物主要反应
酸碱反应由于水合金属离子离解,生成质子,金属离子在水溶液中通常显酸性,例如:
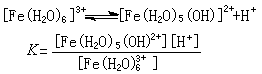
K 是酸离解常数, 可用来衡量水合金属离子的酸性大小,它与金属离子电荷、半径和电子构型有关。一般地说,金属离子电荷高、半径小,电子构型有利于极化作用时,酸性就大;反之就小。这种离解反应还可继续进行,并伴随着聚合,生成羟联或氧联的双核、多核配合物,例如:
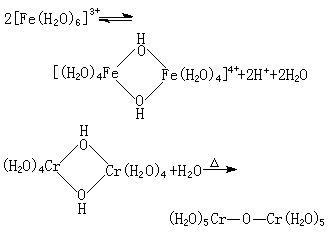
其他含有能离解出质子的配体,还有NH3、乙二胺和有机酸等。
取代反应指配体取代配合物中另一种配体的反应。根据取代反应的快慢,常把配合物分为活性配合物和惰性配合物。金属水合配合物中水被取代的反应速率常作为活性或惰性的衡量标准。取代基可以是水分子或其他配体,如为前者,可用标记原子18O(以符号*O表示)示踪。例如:
[Al(H2O)6]3++6H2*O匑[Al(H2*O)6]3++6H2O
各种水合金属离子的配位水分子与溶液本体中水分子取代速率相差很大。例如碱金属水合离子的取代反应速率常数为108~1010秒-1,而铝和镓的水合离子则为1~103秒-1。离子的大小和所带电荷的多少对反应速率有明显的影响。电荷和结构相同的离子,半径愈大,交换得愈快;离子大小相同者,电荷愈高,交换得愈慢。其他配体取代水合金属离子中的配位水分子的反应速率很少取决于配体的性质,而常与水分子的交换速率一致,即取决于水合金属离子的性质。
电子转移反应指两配合物之间发生电子转移的反应。例如,将 [*Fe(CN)6]4-(*Fe为标记原子)溶液与[Fe(CN)6]3-混合,则前者失去一个电子,后者得到一个电子,其反应为:
[*Fe(CN)6]4-+[Fe(CN)6]3-─→
[*Fe(CN)6]3-+[Fe(CN)6]4-
交换作用在1分钟内完成。这是相同金属和相同配体的配合物的电子转移反应。不同金属和不同配体的电子转移如下:
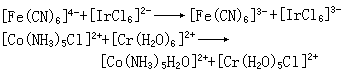
应用
配位化学与无机、分析、有机以及物理化学关系密切,与生物化学、药物化学、农业化学等也有关。在化学和化工方面应用很广。
金属的提取和分离一些重要的湿法冶金过程要利用金属配合物的形成,例如镍、铜和钴可用氨水溶液萃取。在核反应中产生的铍,可用噻吩甲酰三氟丙酮的苯溶液萃取。氰化钠的水溶液通常用于从矿石中分离金。一氧化碳可用于镍的纯化。
化学分析配位反应在元素的重量分析、容量分析和光度分析中有广泛的应用,主要用作显色剂、指示剂、沉淀剂、滴定剂、萃取剂、掩蔽剂等。例如,以氟离子作为掩蔽剂,可与铁(Ⅲ)生成无色而稳定的[FeF6]3-,在用碘量法测铜时避免了铁(Ⅲ)离子的干扰;以二乙酰二肟作为沉淀剂,可使镍和钯同时生成螯合物沉淀,镍的沉淀溶于酸,钯的沉淀不溶,即可分离、鉴定镍和钯;以硫氰酸盐作为显色剂,可与Fe3+离子形成血红色的配合物,即可鉴别Fe3+的存在。EDTA(乙二胺四乙酸)能与大多数的金属离子生成稳定性不一的配合物,是滴定分析中的一种优良的滴定剂,通过控制溶液的pH值和加入掩蔽剂、解蔽剂,用EDTA可从各种金属离子的混合溶液中分别定量地滴定出它们的含量,省去分离干扰元素的步骤。
催化作用过渡金属化合物能与烯烃、炔烃和一氧化碳等各种不饱和分子配位形成配合物,使这些分子活化,生成新的化合物。例如烯烃的氢甲醛化反应中,烯烃与氢和一氧化碳按照与钴催化剂形成配合物的机理,最终生成醛(R为烷基):
RCH=CH2+CO+H2─→RCH2CH2CHO
有些金属催化剂可把烯烃转变为多聚体。例如,将氯化钛(Ⅲ)和烷基铝配位后,作为催化剂,可使烯烃定向聚合成高分子化合物。