[拼音]:yansuan
[外文]:hydrochloric acid
HCl 氯化氢的水溶液,因由食盐制得,故称盐酸。氯化氢在水中的溶解度很大,40°C时,100g水中可溶解63.07g氯化氢,溶解时放出大量热,1mol氯化氢气体的溶解热(无限稀释时)为74.852kJ。工业盐酸按氯化氢含量分31%和35%两种。浓度过高,氯化氢分压会过高,挥发损失量增大。工业盐酸常含氯化铁和游离氯,多呈浅黄色。
性质和用途
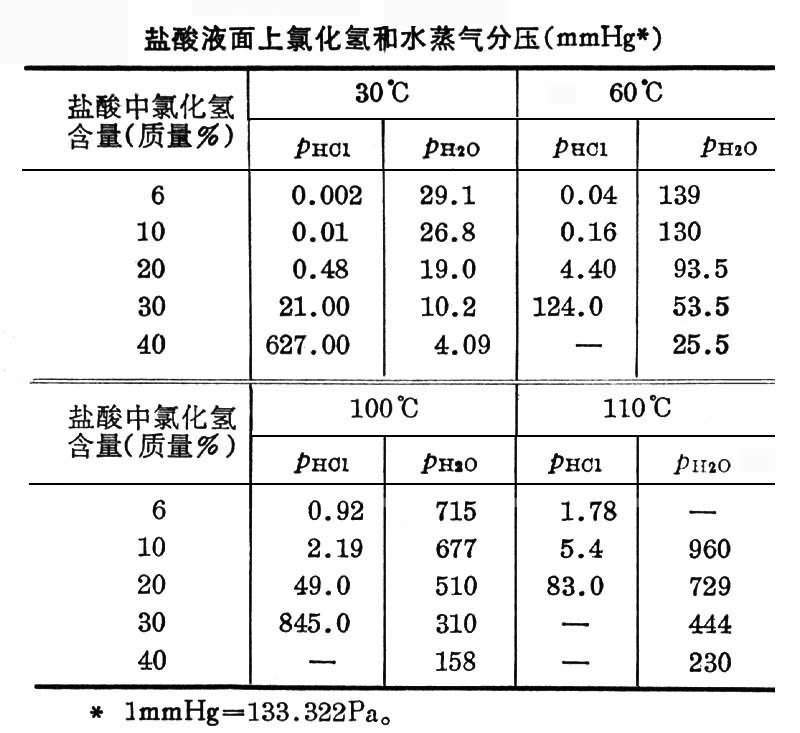
盐酸液面上的氯化氢蒸气分压随盐酸的浓度和温度而异(见表)。盐酸浓度小于20%时,即使温度高至110°C,氯化氢分压仍不大,可忽略不计。盐酸浓度大于20%时,氯化氢分压随温度和浓度升高迅速增大。20.22%的盐酸在0.1013MPa(760mmHg)下为恒沸混合物,沸点108.6°C。 因此,在约 0.1013MPa下加热蒸发浓盐酸可得高浓度氯化氢气体,留下的稀盐酸浓度最低不会小于20.22%。同样原因,加热浓缩稀盐酸,最终盐酸浓度也不会大于 20.22%。由于氯化氢溶解于水时放出大量热,因此,在吸收氯化氢气体制取浓盐酸时,应在低温或用水冷却的情况下进行;而在吸收低浓度氯化氢气体制取稀盐酸(小于20%)时,可在绝热情况下进行,以利用吸收时放出的热量来蒸发一部分水,提高盐酸浓度。
盐酸是典型的非氧化性强酸,对很多金属有强溶解力,并能形成络合离子。为此,常用于分解矿石,溶解水垢,清洗钢板,酸化油井,加工食品,凝聚乳胶,水解有机物,中和碱性物等。很多无机和有机氯化物可直接从盐酸或氯化氢制得。通过电解反应过程,可将盐酸分解为氯和氢。
生产方法
早在炼金术时代已发现有氯化氢气体生成,但到15世纪才有盐酸这一名词的报道。1648年德国人J.R.格劳贝尔用硫酸与氯化钠共热得硫酸钠熔块和氯化氢气体。由于氯化氢气体是从熔融物中馏出,故称此法为熔融干馏法,也称曼海姆法,硫酸钠为主产品,氯化氢为副产品。最初氯化氢未利用,排入大气,产生严重污染。19世纪中叶英国政府通过一项法令,禁止向大气排放高浓度氯化氢气体,乃用水吸收,得酸性溶液盐酸,此法在某些无硫酸钠资源的国家中仍然应用。当原料以流化状态进行反应时,可连续直接获得粉状硫酸钠。如原料硫酸用二氧化硫、氧(由空气来)和水蒸气代替,则可变原来的吸热反应为放热反应,能耗下降,此法称哈格里夫斯法。上述方法所得气体中的氯化氢含量较低,为10%~60%(体积)。由氯和氢直接燃烧可得浓度为95%以上的氯化氢气体,用水吸收可得高浓度、高纯度盐酸,此法称合成法。氯和氢可从电解食盐水制烧碱时获得。大量氯化氢也可从有机氯化物生产(如由苯制氯苯、二氯乙烷制氯乙烯等)中作为副产品获得,称副产法。
1984年几个主要生产盐酸国家(美国、联邦德国、法国、日本等)的产量(按100%氯化氢计)达 5000kt以上,其中以副产法盐酸居多,中国盐酸产量约1500kt。
合成法工业上高纯度盐酸的生产以合成法为主。其典型生产过程(见图),主要包括氯化氢的合成和吸收。
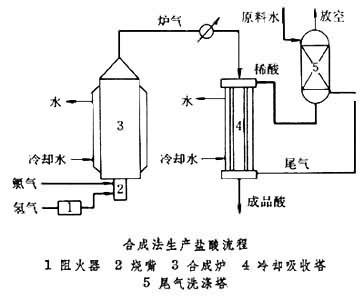
氢气先经阻火器,再通过烧嘴点燃后,于合成炉(见彩图)

中与氯气反应,生成氯化氢。反应气中氢气稍过量,以尽量降低产品中的游离氯。采用带有水夹套的碳钢制合成炉时,炉内温度应维持在露点(250°C)以上,以减少腐蚀。如氢气与氯气配比控制不当,会有爆炸危险。为此,合成炉顶部有防爆装置,下部有光导眼,炉内一旦熄火,通过光电转换器,立即关闭气体的进口阀,并发出警报。 合成炉出口气温度在200~300°C,在管道中经空气和水冷却至150°C左右后,进入水冷式列管吸收塔顶部与由尾气洗涤塔来的稀盐酸呈膜状并流而下,从塔底可得温度约50°C,浓度为32%~35%氯化氢的浓盐酸产品。吸收后的尾气进入尾气洗涤塔的底部与由顶部流下的原料水逆向流动,以回收残余的氯化氢气体。塔底可得浓度约为20%氯化氢的稀盐酸。洗涤后的废气含氯化氢应少于300ppm,经真空水泵或蒸气喷射泵放空。
副产回收是将含有机物的高浓度氯化氢气体,先用稀盐酸吸收得约32%的粗盐酸,再经气提脱除有机物后,得约31%的工业副产浓盐酸。含低浓度氯化氢的有机物经水洗可回收得5%~10%稀盐酸。
贮运
盐酸有强腐蚀性,含有杂质的副产盐酸腐蚀性更大。陶瓷、石英、玻璃、不透性石墨、橡胶、塑料、钼-镍合金、钽、钛及其合金等是常用的耐腐蚀贮运材料。工业盐酸含大量水,一般不宜长途运输。