[拼音]:peng
[外文]:boron
元素符号B,半金属,在元素周期表中属ⅢA族,原子序数5,原子量10.811。常见化合价为+3。
1808年英国化学家戴维 (H.Davy)和法国化学家盖·吕萨克(J.L.Gay-Lussac)、泰纳尔(L.J.Thenard)几乎同时用钾还原硼酸酐(B2O3)制得硼。1892年法国人穆瓦桑(H.Moissan)用金属镁还原硼酸酐制得纯度为98.3%的硼。
自然界中未发现单质硼。有工业价值的硼矿主要有硼砂(Na2B4O7·10H2O)、方硼石(Mg3B7O13Cl)和白硼钙石(Ca4B10O19·7H2O)等。世界上主要的产硼国为中国、美国、苏联、土耳其和阿根廷。中国有很多硼砂含量达80%以上的硼砂矿,纤维硼镁石和钠硼解石。此外四川自贡卤水也是硼的重要来源。
性质和用途
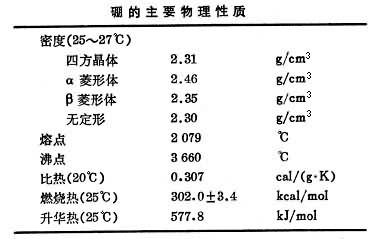
硼有多种同素异形体:四方晶体、α菱形体、β 菱形体及无定形体。无定形硼是一种由深棕色到黑色的粉末。晶体硼是非常硬而脆的固体,有由乌黑到银灰的金属光泽。硼的电导率随温度的升高而增加,例如从290~1070K,电导率约增加200万倍。10B的优异物理性能之一是能吸收中子,其热中子吸收截面为 775靶恩。石墨中有百万分之一的硼足以减缓或停止铀-石墨核反应堆的链式反应。
硼的化学性质主要取决于它的物理状态。无定形硼在空气中甚至在常温下就缓慢氧化,而晶体硼在加热时也很稳定,只能同强氧化剂缓慢地发生作用。高温下无定形硼能在空气中燃烧,产生红色火焰;也能同卤素、氮和金属作用,形成卤化硼、氮化硼和金属硼化物,但不与氢直接发生作用。硼与氢可形成一系列的共价氢化物──硼烷。
硼在高温下能同氧和氮起反应,在冶金工业中常用作去气剂。加0.001~0.005%的硼到钢中,可提高高温强度,使钢的晶粒细化,提高淬透性(见合金钢)。钢件表面渗硼后,能显著增加表层硬度,同时也提高化学稳定性。把0.001~0.003%的硼加到可锻铸铁中,可缩短热处理时间,使石墨细化,分布均匀。硼纤维用作塑料或金属的增强剂,可制成一种强度和硬度比钢高而重量比铝轻的复合材料,成功地应用在航天器中。由于硼烷在燃烧时能放出大量的热,可用作火箭和导弹的高能燃料。同位素10B钢可用作原子反应堆的控制棒和中子屏蔽材料。近年来,硼晶体用于制作滤光器、热敏电阻和耐热耐蚀窗口。高纯硼可作为半导体材料硅和锗的掺杂剂。碳化硼和氮化硼都是硬磨料。金属硼化物已作为金属陶瓷中的一种成分,用于制造耐高温材料。
制取
镁(或铝)热还原法在高温下还原三氧化二硼:B2O3+3Mg→2B+3MgO,得到粗硼。把粗硼分别用盐酸、氢氧化钠和氢氟酸处理,先后除去氧化膜、氧化硼和硼化物,可获得纯度为95~98%的棕色无定形单质硼。
熔盐电解法是一种较经济的、适于大量生产的方法。用KBF4和KCl作电解质,其典型组成(重量)为:70%KCl,12%KF,17.8%KBF4和0.2%H2O。用内衬石墨的电解槽,以蒙乃尔合金作阳极,结构致密的石墨作阴极,在750~800℃电解。阴极电流密度约80安/分米2,槽电压5~6伏。在阴极得到的结晶状硼粉,经过洗涤,干燥后,纯度可达94~96%。电流效率74%,电能消耗约55千瓦·时/公斤硼。
提纯
用氢还原三溴化硼可将粗硼进一步提纯为高纯硼:硼粉和溴蒸气在石英蒸馏釜中于900℃发生如下化学反应:2B+3Br2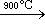 2BBr3。为了除去BBr3液体中的过量Br2,可加入适量的活性炭、锌粒或铝片。所产生的BBr3蒸气冷凝后成为微黄色或无色液体。然后将BBr3液体放入石英精馏塔中,在95℃下精馏提纯。将高纯的BBr3液体和氢气分别通入石英反应管内,在900℃还原成硼粉。产品暗棕色,粒度在 200目以上,纯度可达99.999%。
2BBr3。为了除去BBr3液体中的过量Br2,可加入适量的活性炭、锌粒或铝片。所产生的BBr3蒸气冷凝后成为微黄色或无色液体。然后将BBr3液体放入石英精馏塔中,在95℃下精馏提纯。将高纯的BBr3液体和氢气分别通入石英反应管内,在900℃还原成硼粉。产品暗棕色,粒度在 200目以上,纯度可达99.999%。
- 参考书目
- E.L.Muetteries,The Chemistry of Boron and Its Compounds,John Wiley & Sons, New York,1967.