[拼音]:yuansu zhouqilü
[外文]:Periodic law of elements
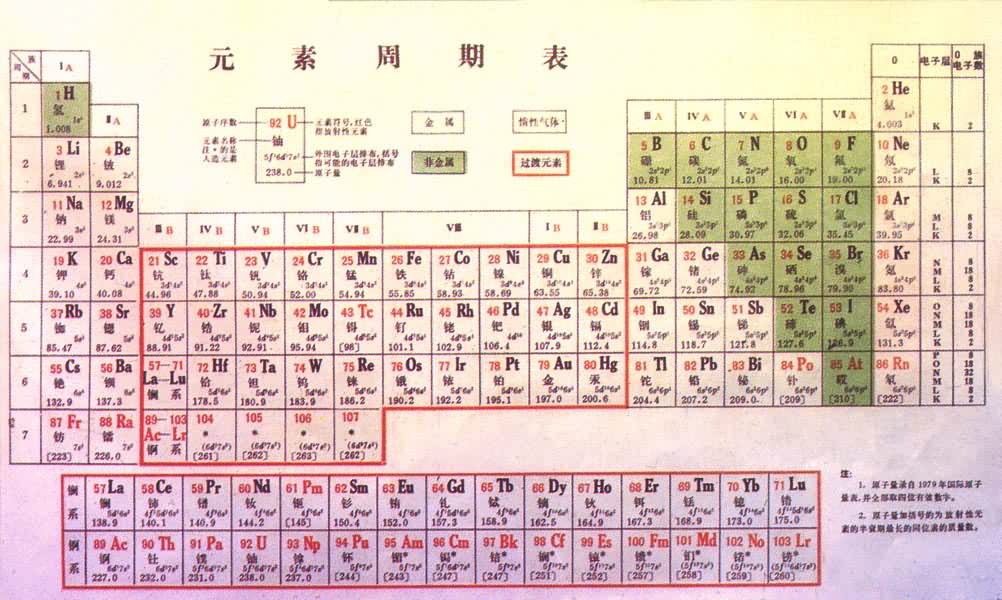
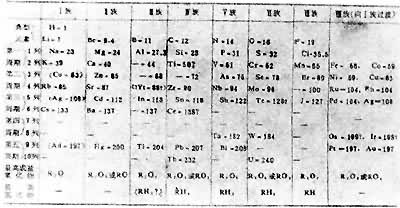
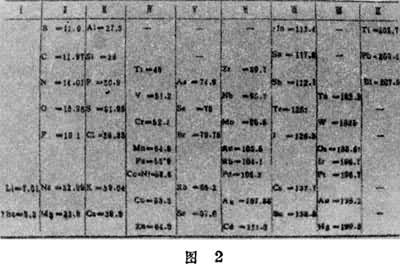
化学元素的性质随原子序数(核电荷数)递增而呈现周期性变化的规律。它以元素周斯表的形式表示出来。随着被发现的元素数目增加,化学家不断探索元素性质的规律性。1829年已知元素超过50种。英国L.奥德林的“原子量和元素符号表”、德国J.L.迈耶尔的“六元素表”和英国L.纽兰兹的“八音律”,都在一定程度上反映了元素的性质及其原子量的相关性。到1869年已知的化学元素达到63种,具备了揭示周期律的条件。俄国化学家Д.И.门捷列夫和德国的迈耶尔在这一年彼此独立地发现了元素周期律。门捷列夫元素周期表01和迈耶尔元素周期表02在内容和形式上是同级水平的。它们都按原子量递增的顺序排列元素,为尚待发现的元素留有空位,并对某些元素当时通用的原子量提出疑问或修改。元素周期律作为经验规律,具有预言未知元素及其性质的理论功能。但迈耶尔对其周期表中的空位未加说明,门捷列夫则利用空位预言新元素。当他所预言的“类铝”(镓)、“类硼”(钪)、“类硅”(锗)相继被证实时,化学元素周期律理论获得了胜利。也正是由于这一点,门捷列夫比迈耶尔更称著于世,后人经常把化学元素周期律同门捷列夫的姓氏相联系。 6种惰性气体元素被发现后,门捷列夫周期表中的每个周期都以惰性元素为结尾,元素的周期数 (共6个)被确定了。然而,从元素按原子量递增的排列顺序来看,却有少数例外,如钾与氩的倒置,这就预示着元素周期律有更深刻的本质尚待揭示。按照周期律,典型周期以活泼金属开始,金属性依次降低,非金属性相应增强,最后以惰性气体元素为收尾。化学元素的性质大体上都按原子量递增的顺序呈现周期性变化,但有少数例外破坏了这种顺序,门捷列夫一直寄希望于重新测定原子量以消除这些倒置现象。19世纪末和20世纪初,通过原子物理学和核物理学的研究才逐步深入地揭示出周期律的内在本质。当揭示出原子序数是核电荷数时,门捷列夫周期表开始发展成为现代形式的化学元素周期表。质子和中子的相继发现又揭示了同位素的本质。同位素是核电荷数(即质子数)相同而中子数不同的一类原子,随着原子序数的递增,原子的质子数递增,一般说来,中子数也递增,因此总起来表现为原子量的递增。元素的原子量是其同位素质量数的平均数,倒置情况是由含中子数多的同位素比重较大造成的。这就使门捷列夫周期表中所遗留的倒置问题得到了解决。量子力学所建立的原子电子壳层理论,更加丰富了周期律的内容。按照这种理论,周期数和电子壳层数是一致的;主族元素的族数和最外层电子的个数是相符合的;惰性元素的最外层电子数的“满员”决定了它们的化学稳定性质。同时,人造元素的出现填补了现代化学元素周期表的许多空白,表中未完成的第七周期已经增长到第107号元素(见彩图)。周期律的发现促进了物理学和化学的统一,加速了整个科学的发展。元素周期律是化学的一条重要规律,唯物辩证法的量变质变规律在这里也有明显的体现。恩格斯曾经指出,门捷列夫“不自觉地应用黑格尔的量转化为质的规律,完成了科学上的一个勋业”(《马克思恩格斯全集》第20卷,第407页)。元素周期律的另一哲学意义在于,它为世界的物质统一性原理提供了丰富和深刻的自然科学基础。同时,周期表完美的对称性显示了自然界的和谐美的形式,具有重要的方法论意义。按照周期表,只要给出某一元素的原子序数,人们就可以据此推知它所在的周期、它的族属、原子核的概况和电子壳层的结构,从而把握它的物理化学性质。周期表的这种对称性将有助于进一步揭示更深层次的“基元物质”和谐美的图景。