酚醛树脂是重要的工业原料,尤其近几年防火材料的大量使用,造成市场对酚醛树脂需求量的逐年增加,生产企业也势必会产生更多有毒有害的苯酚废水。工业酚醛树脂废水中通常含有数千毫克/升、甚至更高浓度的苯酚,若不经处理直接排放不仅造成了苯酚资源的严重浪费,而且会对自然环境带来严重污染和不可估量的损失。苯酚废水的处理方法有很多,如生物化学法、吸附法、化学氧化法、萃取法、膜分离法等。对于高浓度的工业苯酚废水,萃取法不仅能有效地降低废水中苯酚含量,而且能实现苯酚的回收和循环使用。由于萃取法的操作简便、设备要求低,连续操作和间歇操作均可以实现。近年,在苯酚萃取技术方面有很多关于碳酸二甲酯]、磷酸三异戊酯l1 、磷酸三丁酯(TBP)、4一甲基一2一戊酮L13]和辛醇L1 等有机溶剂对苯酚的选择性能的报道。TBP因其性质稳定、对苯酚有高选择性、价格低廉,是苯酚萃取剂的研究热点。
本研究以TBP为萃取剂,以工业酚醛树脂废水为处理对象,研究了油水比、温度、萃取级数、萃取时问等多个因素对萃取效果的影响。同时,通过正交实验探讨了NaOH溶液对有机相的反萃取效果,研究了萃取剂的循环使用性能及苯酚回收率。
1材料与方法
1.1主要试剂及仪器
某企业工业酚醛树脂废水(以下简称废水):经过静置沉降,苯酚质量浓度为2145.0mg/L,pH≈1;NaOH(工业级);TBP、苯酚、铁氰化钾、4一氨基安替比林、氨水、氯化铵(均为分析级)。
傅立叶红外光谱仪;722N型可见分光光度计;SZCL一2型控温磁力搅拌器。
1.2苯酚分析方法
水相中苯酚分析根据《水质挥发酚的测定4一氨基安替比林分光光度法》(HJ503--2009)测定。通过物料衡算可以得到有机相中苯酚浓度。
1.3实验方法
1.3.1萃取
取6OmL废水,置于250mL锥形瓶中,按油水比为1:3(体积比)加入2OmLTBP,在控温磁力搅拌器上快速搅拌20min,于250mL分液漏斗中静置分层,并重复上述操作进行4级萃取。取一定量水相,测定其苯酚浓度,通过物料衡算可以得到有机相中苯酚浓度。
1.3.2反萃取
有机相与设定浓度的NaOH溶液按一定油碱比混合于250mL锥形瓶中,在控温磁力搅拌器上快速搅拌1h,于250mL分液漏斗中静置分层,萃取剂循环使用,回收苯酚。
2结果与讨论
2.1萃取单因素实验
2.1.1TBP对不同苯酚初始浓度废水的分配系数(D)因工业酚醛树脂废水的苯酚浓度在较大的范围内会有变化,所以萃取剂对不同浓度的苯酚废水要有较稳定的分配系数。取5组100mL废水,1组稀释4倍,2组稀释2倍,3组不做处理,4组加入100mg苯酚,5组加入200mg苯酚,配制了如表1所示的5种不同苯酚初始浓度的废水,用TBP进行一级萃取(油水比1:3)。
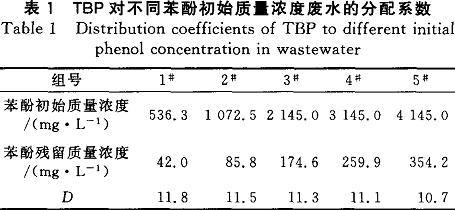
废水稀释了2、4倍,稀释后的pH由1左右分别变为1.3、1.6,仍然具有较强的酸性。在酸性条件下,苯酚保持分子特性,即可以与TBP进行络合反应。pH在酸性范围内的变化,对TBP萃取苯酚的效果影响较弱,基本可以忽略。从表1可以看出,TBP对苯酚在一个较大的浓度范围内都有较高且稳定的分配系数。这是由于TBP分子中的配价P—O的存在,使氧原子带有更强的负电性,同时苯酚一0H中氧原子和氢原子的共用电子对强烈偏向于氧原子,使氢原子带有较强的正电性。当2种分子接近时,TBP的P—O与苯酚的C—O会发生氢键缔合。
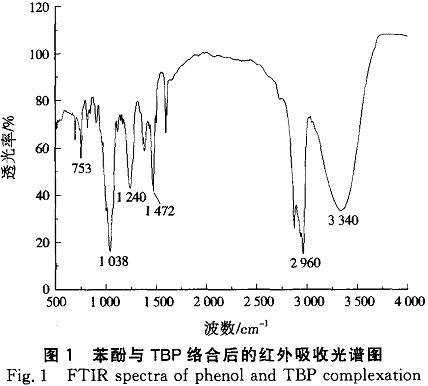
图1是苯酚与TBP络合后的红外吸收光谱图。
在3600cm以上基本无红外吸收,说明已没有游离的酚羟基存在;在3340cm处出现了宽且强的吸收峰,可能是苯酚的一OH发生氢键缔合的原因造成的;I240cm为TBP的P—O特征吸收峰,1038cm为苯酚的C一0特征吸收峰,较未缔合前的1185、1269cm均发生了较大的红移,也说明了TBP的P—O与苯酚C—O形成了较稳定的氢键缔合。
2.1.2温度对分配系数的影响
苯酚和TBP由于存在氢键缔合,在水和TBP中存在以下平衡:
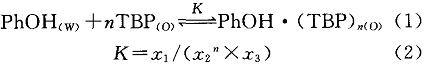
式中:n为化学反应系数;K为平衡常数;z、32、32。分别为有机相中苯酚和TBP的络合物、有机相TBP、水相苯酚的摩尔浓度,mol/L。当达到萃取平衡时其分配系数为:
![]()
式中:.z、z分别为有机相苯酚、水相中游离苯酚的摩尔浓度,mol/L;D。为理论分配系数;P为pH;P为酸碱解离常数(pK)。因为pK=9.87,所以酸性条件下可认为D=D。。则式(2)和式(3)式可以转换为:
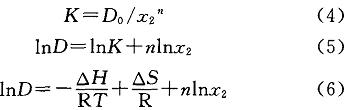
式中:△H为焓变,J/tool;R为理想气体常数,J/(mol•K),R一8314J/(tool•K);T为温度,K;AS为熵变,J/mol。一般认为,熵变不随温度变化,则式(6)可简化为:
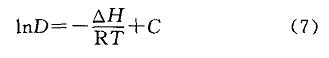
式中:C为简化相。
图2是TBP对苯酚的分配系数与温度的关系。经线性拟合,可以求得TBP对苯酚的焓变为一1O.1kJ/mol,与文献E19]报道的数值相近。一般,氢键的能量为4.2~42.0kJ/mol,因此也可认为TBP与苯酚之间形成了氢键缔合物。由焓变可以确定,TBP与苯酚的络合过程是一个放热的过程,高温不利于萃取进行,因此在室温下进行苯酚萃取是合理的。
由于温度313K以上,苯酚在水中的溶解度呈现指数型上升,同时温度较高时,TBP在水中的溶解度也增大,使TBP对苯酚的分配系数迅速下降,因此lnD出现了一个较大范围的跳跃(见图2)。
2.1.3油水比和萃取级数对萃取效果的影响
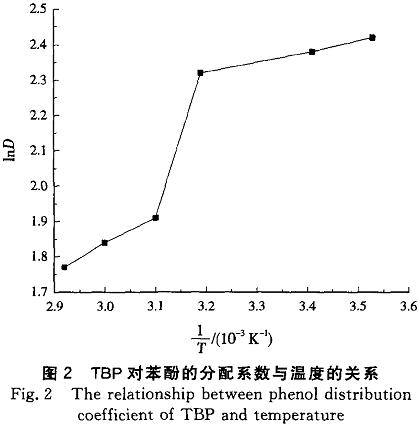
由图3表明,随着油水比的增大,苯酚残留浓度减少,即苯酚在TBP中的分配系数增大,这是由于苯酚分子周围有更多的TBP分子,增加了氢键缔合的机率。但是增大油水比虽有较好的萃取效果,却大幅度降低了单次废水的处理量,对于工业废水的处理除考虑效果外还要兼顾效率,因此油水比选择更适合工业实际的1:3。
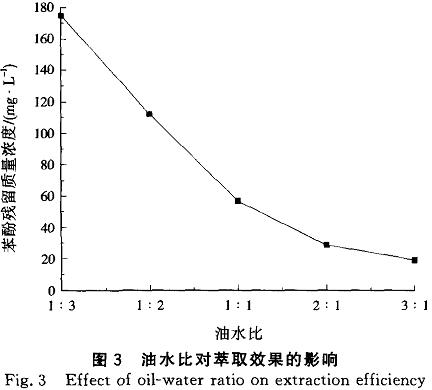
式(8)可近似计算废水达到《污水综合排放标准》(GB8978--1996)中挥发酚一级排放标准(0.5mg/L)所需的理论萃取级数(N)。根据表1,油水比为1:3时,取TBP对苯酚的分配系数为11.0进行计算,废水达标所需的理论萃取级数为4级。由图4可见,当油水比为1:3时,达标所需的实际萃取级数与理论萃取级数相同,均为4级。
![]()
2.1.4萃取时间对萃取效果的影响
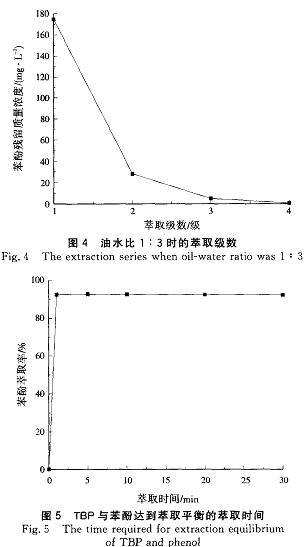
萃取时间是萃取剂性能的一个重要指标。在实际废水处理中,较短萃取时间不仅可以提高废水处理效率,而且降低了废水处理成本。图5为TBP与苯酚达到萃取平衡的萃取时间。由图5可见,1rain左右,TBP与苯酚废水即可达到萃取平衡,可见TBP对苯酚具有很好的选择性能。考虑到实验室废水处理量较小,搅拌1min基本可以混匀,但实际工业操作时废水量巨大,充分搅拌需要较长时间,为保持实验结果的稳定性,故萃取时间选为2Omin。
2.1.5最佳萃取条件
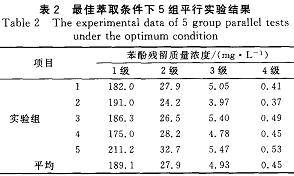
通过单因素实验,确定了TBP对苯酚的最佳萃取条件:室温,油水比1:3,萃取时问20min,4级萃取。在最佳萃取条件下进行5组平行实验,结果见表2。每组实验结果都较稳定,4级萃取后苯酚残留质量浓度平均值为0.45mg/L,达到GB8978~1996中挥发酚一级排放标准。
从表4可以看出,NaOH浓度对苯酚回收率的影响最小。在反萃取过程中,NaOH起到解络合的作用,在反萃取体系中要有足够的自由碱浓度,才能保证反萃取的进行。
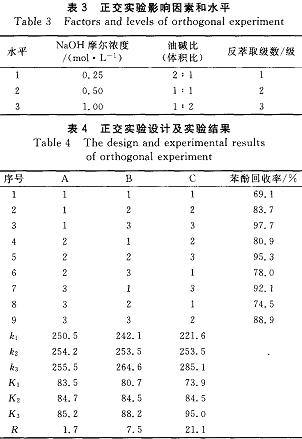
因企业废水中苯酚浓度会发生变动,故采用0.50tool/L的NaOH溶液做反萃取剂。当油碱比为1:1、1:2时,均具有较好的苯酚回收率。考虑到减少NaOH溶液用量可以降低苯酚回收成本,提高经济效益,因此选择油碱比为1:1。由于TBP经过2级反萃取后,其中的苯酚含量很低,TBP不经过第3级反萃取进人循环,不影响其萃取性能,且TBP中残余的微量苯酚经过萃取剂的循环后也可回收,因此选择2级反萃取。综合确定最佳反萃取条件:0.50mol/LNaOH溶液,油碱比1:1,反萃取级数2级。在此最佳反萃取条件下,可回收9O9/6左右的固体苯酚。
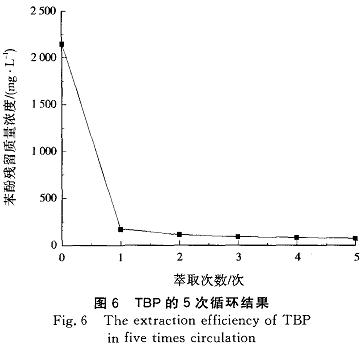
由图6还可见,多次循环后,TBP萃取苯酚的效率有小幅度的提高,可能是由于进行反萃取时有部分NaOH溶解到TBP中,当TBP再循环萃取废水时,TBP中的NaoH与酸性废水部分酸碱中和形成了盐。由于盐具有水合作用,吸引了部分自由水分子,使废水中的自由水分子的含量减少,废水中苯酚浓度相应增加,从而有利于TBP萃取苯酚。。
3结论
(1)TBP对苯酚在一个较大的浓度范围内都有较高且稳定的分配系数。
(2)红外吸收光谱图显示,TBP的P—O特征吸收峰和苯酚的c—O特征吸收峰较未缔合前发生了较大的红移,说明TBP的P—O与苯酚c—O形成了较稳定的氢键缔合。
(3)经TBP对苯酚的分配系数与温度关系的线性拟合,可以求得TBP对苯酚的焓变为一10.1kJ/mol,可以确定TBP与苯酚的络合过程是一个放热的过程。
(4)TBP对苯酚的最佳萃取条件:室温,油水比1:3,萃取时间2Omin,4级萃取。在最佳萃取条件下,4级萃取后苯酚残留质量浓度平均值为0.45mg/L,达到达到GB8978--1996中挥发酚一级排放标准。
(5)最佳反萃取条件:0.50mol/LNaOH溶液,油碱比1:1,反萃取级数2级。在此最佳反萃取条件下,可回收9O左右的固体苯酚。














