[拼音]:shiji qiti zhuangtai fangcheng
[外文]:equation of state for actual gases
描述实际气体状态变化的方程。1847年,H.-V.勒尼奥做了大量实验,发现除氢气以外,没有一种气体严格遵守玻意耳定律(见理想气体状态方程)。以后随着实验精度的提高,人们发现实际气体有着与理想气体不同的性质,如体积变化时内能也发生变化、有相变的临界温度等(见相和相变)。实际气体的分子具有分子力,即使在没有碰撞的时刻,分子之间也有相互作用,因而其状态的变化关系偏离理想气体状态方程。只是在低压强下,理想气体状态方程才较好地反映了实际气体的性质,随着气体密度的增加,两者的偏离越来越大。
常为人们引用的实际气体状态方程为范德瓦耳斯方程和H.开默林-昂内斯所提出的级数形式的方程。
18世纪,D.伯努利提出了气体分子的刚球模型,考虑到分子自身体积的影响,把气体状态方程改为p(V-b)=RT的形式。1873年J.D.范德瓦耳斯假设气体分子是有相互吸引力的刚球,作用力范围的半径大于分子的半径。气体分子在容器内部与在容器壁处受到的力不同,相当于气体的压强p┡比容器对气体所施加的外压强 p要大一些,为p┡=p+p',p'叫气体的内压强。这个附加的压强与体积V的二次方成反比,等于 ,a是一个常量。再考虑分子自身的体积及平均自由程在分子运动中的作用把状态方程修改成:
,a是一个常量。再考虑分子自身的体积及平均自由程在分子运动中的作用把状态方程修改成:
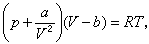
式中b也是一常数。a、b都要由实验确定。实验上测定a和b的方法很多,例如在一定温度下,测定两个已知压强对应的体积值,便可由范德瓦耳斯方程定出a和b的值。表中列出了一些常见气体的a、b的实测值。
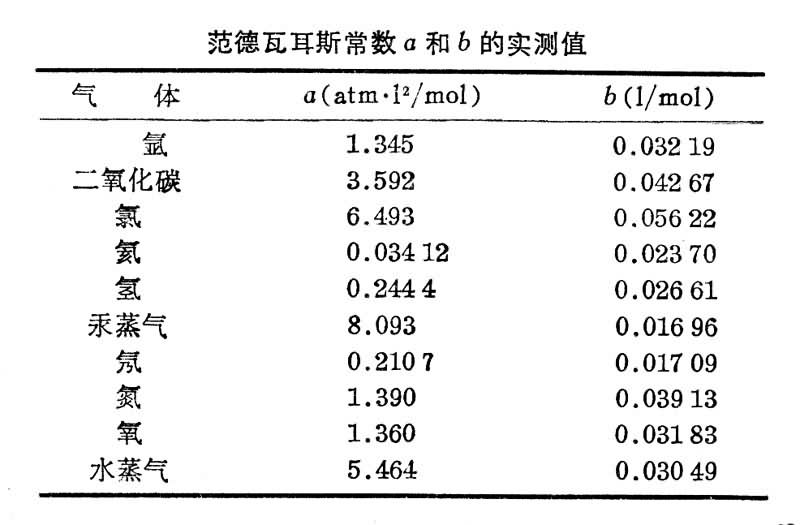
范德瓦耳斯方程能较好地给出高压强下实际气体状态变化的关系,而且推广后可以近似地应用到液体状态。它是许多近似方程中最简单和使用最方便的一个。
开默林-昂内斯提出了一个按体积V的负幂次展开的级数形式的气体方程:
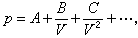
式中A、B、C …都是温度的函数,并与气体的性质有关。他把这些系数分别叫做第一、第二、第三、……维里系数。这是实际气体状态方程最完全的形式。
1937年,J.E.迈尔用集团展开的办法求得了各级维里系数的表达式,从而完全解决了实际气体状态方程问题(见维里定理)。从迈尔的计算也可看出,级数形式的状态方程中,展开式的第一项相当于理想气体的情况,即分子间不存在相互作用;第二项是考虑了分子成对的相互作用;而后的各项则是考虑了3个、4个分子相互作用的结果。