[拼音]:linjie zhuangtai
[外文]:critical state
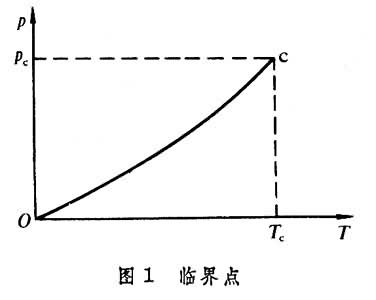
物体从均匀状态开始出现性质有定量差异的两相时所处的状态。在以压强p和温度T为坐标的平面上,相平衡曲线(见相和相变)可能终止于某一点c,这一点叫临界点,如图1所示。临界点的温度称为临界温度Tc、压强称为临界压强pc,体积为临界体积Vc。温度高于临界温度时物体总是均匀的,没有不同的相。在临界点处,两相连续过渡,没有相变潜热,两相之间的差别完全消失。
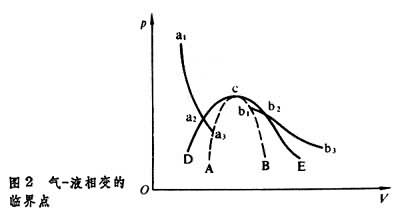
从气-液相变的过程可以看到临界状态的具体性质。在图2所示的p-V平面上画出液体等温线和气体等温线。可以看出,等温膨胀时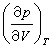 <0,在此区间内,液体的等温线从a1下降,在a2点穿过液体和气体的平衡曲线DcE后到a3点终止。a3点处
<0,在此区间内,液体的等温线从a1下降,在a2点穿过液体和气体的平衡曲线DcE后到a3点终止。a3点处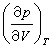 =0。气体的等温线从b1点开始下降, 在b2点穿过液体和气体的平衡曲线DcE。b1点处也有
=0。气体的等温线从b1点开始下降, 在b2点穿过液体和气体的平衡曲线DcE。b1点处也有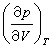 =0, 两条等温线是断裂的,不以连续的方式从液体向气体过渡。 a2a3区间相应于亚稳态的过热液体,b1b2区间相应于亚稳态的过冷气体。AcB 是液体等温线和气体等温线的端点描绘的曲线,在这条线上
=0, 两条等温线是断裂的,不以连续的方式从液体向气体过渡。 a2a3区间相应于亚稳态的过热液体,b1b2区间相应于亚稳态的过冷气体。AcB 是液体等温线和气体等温线的端点描绘的曲线,在这条线上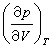 =0。曲线AcB与曲线DcE在c点相切,c点就是临界点。c点处同时满足三个条件
=0。曲线AcB与曲线DcE在c点相切,c点就是临界点。c点处同时满足三个条件
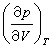 =0
=0
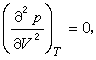
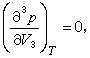
从临界点的这三个条件可以确定临界状态的性质。
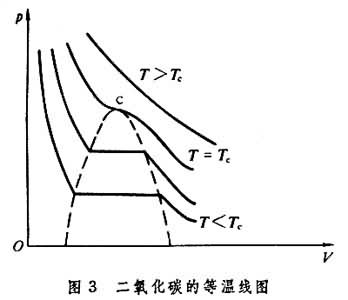
1869年,T.安德鲁斯用一个下端开口的玻璃管把二氧化碳限制在水银面上,调节管中水银量以改变玻璃管上半部的容积。他用这种方法得到如图3所示形式的第一张等温线图,图中c点为临界点。这个方法经过一些修改沿用至今。
1869到1950年间随着资料的不断积累,出现了各种有关临界状态的不同学说。1881年J.D.范德瓦耳斯提出的实际气体状态方程,是各种理论中形式比较简便而且仍能较好地反映客观实际的近似方程。如果用p、V、T分别与其临界常数的比值
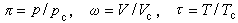
来表示,可以把范德瓦耳斯方程改写成如下无量纲的形式
(h+3/ω2)(3ω-1)=8τ。
这方程中不包含任何表征给定物质的量,所以它是适用于任何符合范德瓦耳斯方程气体的普遍方程,即各种气体在相同的h、τ下就有相同的ω,这个结论称为对应状态原理。处于对应状态的各种物质,许多性质(如蒸气压,热膨胀系数、粘滞系数等)都具有简单的关系,用这个原理可以不用实验而能相当精确地估计物质的某些性质。
在临界点附近,物质出现一些异常现象:物质呈乳浊现象,这现象叫作乳光;液体有可压缩性;定压比热容迅速趋向无穷大,而定容比热容发散较慢。
对临界状态的研究,除液-气两相以外,还扩展到铁磁体、铁电体、液体氦和二元合金等领域。近代在实验和理论方面都取得了很大进展。