[拼音]:suanjian cuihua zuoyong
[外文]:acid-base catalysis
以酸碱作催化剂的催化。反应物分子与酸碱相接触,或吸附在催化剂固体表面一定的酸碱部位上,就会发生酸碱反应,形成活性中间络合物,然后再分解出产物,使催化剂复原。
均相酸碱催化反应主要有水解、水合、缩合、酯化、烷基化、重排等(多为液相)。例如,乙烯在硫酸催化剂的作用下水合为乙醇;环氧氯丙烷在氢氧化钠催化剂的作用下水解为甘油;苯和卤代烃在三氯化铝催化剂的作用下烷基化为烷基苯。
多相酸碱催化反应主要有烯烃聚合、催化裂化、烯烃和烷烃的异构化、缩合、加成、歧化等(催化剂为固相)。例如,烷烃在REY分子筛和(或)硅铝胶上催化裂化为汽油和C3、C4气体;苯和乙烯在固体磷酸上烷基化为乙苯;丙烯在硫酸镍上低聚;烯烃在固体碱(碳酸钠或碳酸钾)催化作用下二聚等等。
有些反应既可酸催化也可碱催化,唯产物不完全相同。例如,芳烃和单烯在酸催化下反应生成的产物是烷基加到芳香环上生成的,而碱催化作用则使芳烃的侧链烷基化。又如,在酸或碱催化作用下,烯烃可发生顺、反异构化和双键异构化反应,而仅在酸催化作用下尚可发生骨架异构化反应。
布仑斯惕酸碱催化反应包括质子转移;路易斯酸碱催化反应包括共价配键的形成(见酸碱理论)。
若催化剂为酸或含有酸中心,则反应物分子必须含 有易于接受质子或给出电子对的原子或基团;若催化剂为碱或含有碱中心,则反应物分子必须易于给出质子或接受电子对。
此外,针对不同的催化反应,反应物分子在催化剂表面的吸附能力和催化活性还随催化剂酸碱性质的不同而异。酸碱催化反应须在特定种类的酸碱中心上进行,并需要一定的酸强度范围。酸碱催化作用在均相催化或多相催化中均有应用,是液相催化中最常见的催化作用,在化学工业中应用很广。
固体酸碱中心固体有两种酸中心:路易斯酸中心和布仑斯惕酸中心,另外还有碱中心。路易斯酸中心正像分子路易斯酸一样,具有未被占据的轨道,对电子对有较高的电子亲合势。路易斯碱中心的一个高能级上有电子对,如果它和一个被吸附的电子接受体二者只有此电子对,则能量将降低。布仑斯惕酸中心具有释放一个质子的倾向。
固体酸碱种类繁多,如载于固体上的液体酸碱,金属氧化物(如氧化铝、氧化镁、氧化钛、氧化锌)、硫化物(如硫化锌、硫化钙)和氯化物(氯化汞、氯化铜、氯化铝),混合氧化物(如氧化铝-氧化硅、氧化硅-氧化镁),沸石和金属硫酸盐、磷酸盐等。现以氧化铝、脱阳离子沸石为例,说明路易斯酸、布仑斯惕酸和碱中心的各自成因。氧化铝是由水合氧化物受热脱水而产生:
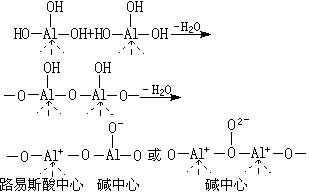
此路易斯酸中心易吸水变为布仑斯惕酸中心:
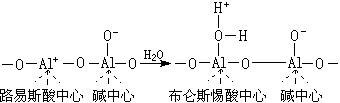
酸、碱中心的种类和数目与制备条件、焙烧温度以及脱水程度等密切有关。它的表面酸主要为路易斯酸。脱阳离子沸石的酸、碱中心的形成如下:
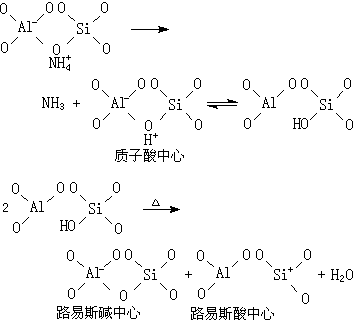 碱催化反应机理
碱催化反应机理
对于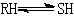 反应,若RH为弱酸,则其反应机理如下:
反应,若RH为弱酸,则其反应机理如下:
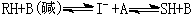
RH与碱催化剂作用,形成过渡态I-负离子和酸,然后生成产物SH,催化剂碱复原。例如,碳氢化合物的碱催化反应是通过负碳离子中间物进行的:
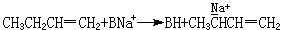
式中B为H、NH2、烷基或芳香基。
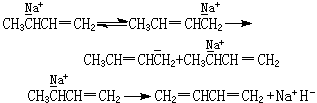 酸催化反应机理
酸催化反应机理
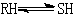 反应的反应机理如下:
反应的反应机理如下:
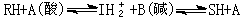
式中R、I、S为取代基。如RH为一弱碱,则它与酸催化剂相互作用,质子由催化剂转移至反应物,形成过渡态IH娚正离子和碱,然后得到产物SH,同时酸催化剂恢复原有化学性质。均相催化和多相催化一样,均按离子机理进行。对布仑斯惕酸碱催化反应而言,其机理中包含质子转移。以1-丁烯的酸催化异构化为例,说明具体的反应机理:
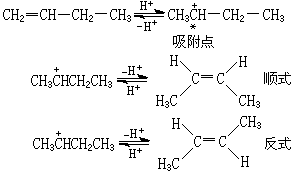 首先,1-丁烯吸附在催化剂表面,与质子酸中心作用,形成正碳离子络合物,然后异构化为顺、反式丁烯。因催化剂酸中心的数目和类型以及温度的不同,顺、反式的产率各异。
首先,1-丁烯吸附在催化剂表面,与质子酸中心作用,形成正碳离子络合物,然后异构化为顺、反式丁烯。因催化剂酸中心的数目和类型以及温度的不同,顺、反式的产率各异。
一个催化剂上如有两个活性基团:一个酸性基团和一个碱性基团,则即使基团的酸、碱强度是中等的,二者的协同作用也能产生很强的特殊催化效果。这种催化作用称为酸碱协合催化作用,其机理有时也称为“协同”、“三元”机理等:
Am+RH+Bn─→Bm+SH+An
例如,α-D-四甲基葡萄糖在苯溶液中旋光可以改变,即从α型转变为β型。对此反应,2-羟基吡啶是一个很有效的催化剂。虽然它的碱强度是吡啶碱强度的1/104,而酸强度是苯酚酸强度的1/100,但是0.001Μ2-羟基吡啶的催化效果比 0.001Μ吡啶和 0.001Μ苯酚混合物的效果大7×103倍。其原因就在于同一催化剂中酸碱集团的协合作用。Ж.图尔凯维奇还曾指出,硫酸催化可使1-丁烯异构化为2-丁烯:
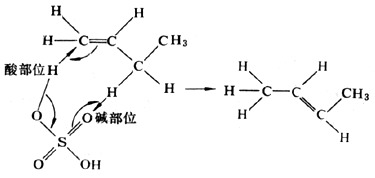
硫酸的这种较高的催化活性,同样归因于它的酸碱协合作用。