[拼音]:suanjian lilun
[外文]:acid-base theory
阐明酸碱本质的理论。阿伦尼乌斯电离理论所述的酸碱观点在建立酸碱理论过程中是一个重大的进展,但他的理论不能解释某些不含氢氧根离子的物质是一种碱;也不能包括非水体系中的酸碱反应。后来又有下列几种酸碱理论。
酸碱质子理论1923年丹麦科学家J.N.布仑斯惕和英国科学家T.M.劳里同时提出酸碱质子理论:酸(A)是具有给出质子倾向的物质,而碱(B)是具有接受质子倾向的物质,例如:
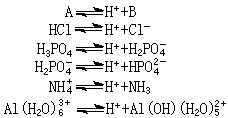
相差一个质子的两种物质(即A和B)叫共轭酸碱对。
按照这个理论,HCl、H3PO4是分子酸,NH嬃、Al(H2O)扟是阳离子酸,H2PO嬄是阴离子酸;而NH3是分子碱,Al(OH)(H2O)崬是阳离子碱,H2PO嬄、Cl-是阴离子碱。有些物质(如H2PO嬄)在某一共轭酸碱对(如 H3PO4-H2PO嬄)中是碱,而在另一共轭酸碱对(H2PO嬄-HPO娸)中是酸。酸给出质子的倾向愈强,则其共轭碱接受质子的倾向愈弱;若碱接受质子的倾向愈强,则其共轭酸给出质子的倾向愈弱。
质子传递反应只能发生在两个共轭酸碱对之间:
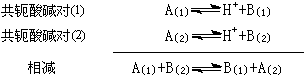
若A(1)是强酸,B(2)是强碱,则质子传递反应向右进行;若B(1)、A(2)是弱碱和弱酸,则质子传递反应也能向右进行。反之,生成强酸、强碱的反应是很难进行的。
酸碱质子理论认为,阿伦尼乌斯理论中所谓的弱酸、弱碱电离平衡,弱酸根、弱碱根离子水解,中和反应,盐的生成,水的自电离等都是质子传递反应(表1)。

各种酸的强度,可通过测定它们在同一种碱中质子传递的倾向来比较。若选用水作为碱,则可得到各种酸在水中电离常数的序列。这与阿伦尼乌斯酸碱电离理论基本相同。若改用接受质子倾向更强的溶剂(如液氨)作为碱,则各种酸给出质子的倾向都强于它们在水中给出质子的倾向。如在水溶液中盐酸和乙酸给出质子的倾向有明显的差别,而在液氨溶剂中它们与液氨间的质子传递反应都很完全,以致很难区别它们的强度。这种把盐酸、乙酸变得几乎具有同等强度的溶剂叫调平溶剂,所产生的这种效应叫调平效应。在强酸(如硫酸)溶剂中,某些常见的酸将接受质子(碱)。例如,HNO3在H2SO4介质中将接受质子,因此是碱:
H2SO4+HNO3─→HSO嬄+H2NO幦
质子理论把酸碱范围扩大了。质子酸实际上是质子和共轭碱的加合物,酸碱反应都可用质子传递来讨论。
路易斯酸碱理论1923年美国科学家G.N.路易斯从结构观点提出广义的酸碱电子理论:给出电子对的物质是碱,接受电子对的物质是酸,酸碱结合成加合物(表2)。
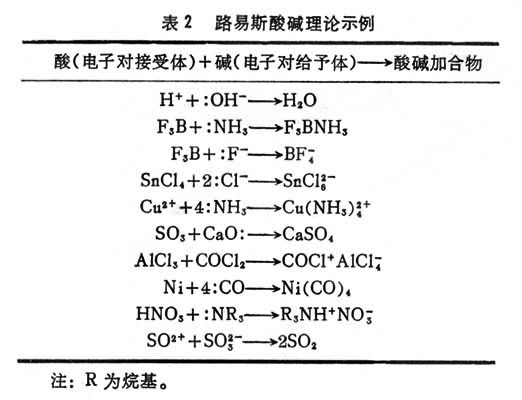
路易斯理论包括的范围很广,按照它,阿伦尼乌斯理论中的酸,如HCl中,Cl-是电子对给予体(碱),H+是电子对接受体(酸);NaOH中的OH-是电子对给予体(碱),Na+是酸。在质子理论中,至少有一对未共用电子对的碱就是路易斯碱,如NH3。在溶剂体系理论中,SOCl2中的SO2+是酸,Cl-是碱;Cs2SO3中Cs+是酸,SO娫是碱;SO2+和SO娫结合成SO2。由于路易斯酸(碱)理论的适用范围可包括其他理论的范围,因此又称广义酸(碱)理论。
按照路易斯理论,酸(A)和碱(B)的反应如下:
(1)双取代反应(表3):表中所列A(1)是较强的酸,B(2)是较强的碱,A(1):B(2)是较稳定的加合物,即酸碱反应本质是,强酸和强碱取代弱酸和弱碱,生成配位键(见共价键)较强的加合物,这是配位键的调整而不是生成新的配位键。
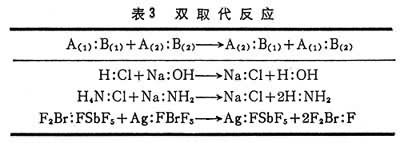
(2)碱取代反应(表4)表中前四个例子是质子酸,后两例中的酸是金属离子。反应实质是:原先与B(1)结合的A(1)转为与更强的碱B(2)结合,即B(2)取代B(1),与A(1)结合。这种反应又称亲核取代反应。
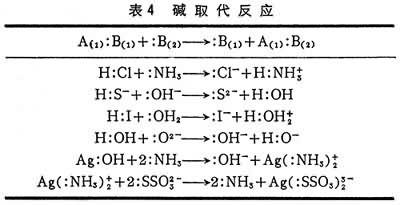
质子理论中的质子传递反应就是路易斯理论中有质子参与的亲核取代反应。但是亲核取代反应不一定是质子传递反应,如表中最后一个实例。亲核取代反应中,因核不同,取代顺序有所改变。例如,与H+结合时,OH-强于NH3;而与Ag+结合时,NH3强于OH-。
(3)酸取代反应(表5):原先与H+结合的OH-转为与CO2结合,又转为与SO3结合。这种反应又称亲电取代反应。

路易斯理论广泛应用于有机化学。例如,CH幦、C2H嵱、CH3CO+等都是酸,分别与碱H-、OH-、C2H5O-结合成加合物CH4、C2H5OH、CH3COOC2H5。又如苯的硝化反应:
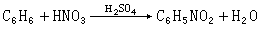
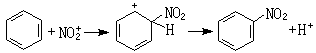
目前认为在以上反应过程中 HNO3与H2SO4反应生成路易斯酸NO娚。NO娚是亲核的,与苯发生反应:
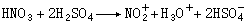
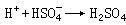 其他酸碱理论
其他酸碱理论
(1) 溶剂体系理论 与水相似,许多溶剂能自电离,形成特征的阳离子和阴离子:
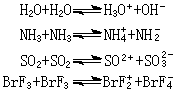
H.卡迪和H.P.埃尔西提出:凡是能增加溶剂中特征阳离子浓度的物质是酸,如酸的水溶液、液氨中的铵盐等;凡能增加溶剂中特征阴离子浓度的物质是碱,如氢氧化钠的水溶液、液氨中的氨基化钠 NaNH2等。中和就是生成溶剂的反应,如在液态二氧化硫体系中:
Cs2SO3+SOCl2─→2SO2+2CsCl
Cs2SO3和SOCl2滴定,就像在水溶液中酸碱滴定生成水一样。溶剂体系适用于能解离的溶剂。
(2)乌沙诺维奇理论 又称正负理论。1939年苏联科学家М.И.乌沙诺维奇提出:凡能与碱反应,给出阳离子,接受阴离子或电子的物质是酸;凡能与酸反应,与阳离子结合,给出阴离子或电子的物质是碱。这个理论几乎包括所有路易斯理论的酸碱反应,如:
Na2O+SO3─→2Na++SO娸
2Na+Cl2─→2Na++2Cl-
前一反应中的酸是SO3,因它得到O2-生成SO娸;后一反应中Na把电子给予Cl,所以Na是碱。即氧化剂是酸,还原剂是碱。乌氏酸碱理论包括了氧化还原反应,适用范围更广。
(3)勒克斯-弗勒德理论 1939年H.勒克斯提出的,1947年经H.弗勒德发展的以“O2-”离子来定义酸碱的理论。氧离子给予体是碱,氧离子接受体是酸,如:
CaO+SO3─→CaSO4
式中CaO是碱;SO3是酸。这种理论适用于含氧而不含质子的反应体系,主要用于熔融的氧化物体系。
- 参考书目
- J.C.Bailar,Jr.,et al.,Comprehensive InorganicChemistry, Pergamon, London, 1973.