印染、皮革、造纸、印刷和制药等行业在生产过程中会产生大量含有染料的有色废水。有色废水中的染料大多数为含偶氮基和多个苯环的有机大分子化合物,这类物质本身的可生化性差,属难降解的有机污染物,一旦残留于水体经过活化反应会产生对生态环境和人体有害的物质。加之染料正朝着抗氧化、抗光解和抗生物降解的方向发展,使染料废水的处理难度越来越大。阳离子染料因色泽鲜亮,着色力强且着色速度快在生物染色、羊毛、人造纤维、皮革和纸张等领域得到了广泛应用。但阳离子染料因相对分子质量大、结构稳定、颜色深、碱性大、含有芳香胺等致癌成分使其成为染料废水处理必须面对和解决的一个问题,而常规的水处理技术,如生物法和物理化学处理法很难将其有效降解。因此探索高效、低成本、无二次污染的高级氧化处理技术具有重要的意义。
放电等离子体技术是一种新型的高级氧化技术。在放电过程中,会产生多种强氧化性物质,如羟基自由基(·OH)、O3、H2O2等,同时有紫外辐射,因此对污染物的降解是多种效应协调作用。尤其是对难去除的有机污染物的降解不受温度、浊度影响,降解彻底无残留、无二次污染,而且设备灵活、成本较低、操作条件宽,较传统处理方法有显著的优势而受到国内外许多研究者的广泛关注。虽然采用放电等离子体对染料废水进行处理的报导很多,但大多数为偶氮染料,对更难降解的阳离子染料报导不多。
本研究采用针- 面型接触式辉光放电对阳离子染料番红花红T 模拟废水进行实验,考察了几种可能影响脱色效果的因素,对降解机理进行了初步探索。以期对放电等离子体废水处理的工业化应用可提供基础数据和设计参考。
1 实验部分
1.1 实验装置
实验的反应装置为针- 面型结构,如图1 所示。

直流电源系统由调压器(调压范围0~250 V),升压变压器和桥式整流、电容滤波电路组成。220 V的交流电经过此电源系统. 后可以得到一个高压直流输出(最高电压可达25 kV)。电源正极和带针尖的钍钨电极(阳极)相连,阳极直径1.59 mm,长度77.54 mm;电源负极和放置于待处理溶液底部的铜丝相连,即待处理溶液可看作是阴极。反应器是一圆柱形玻璃容器,高20 mm,直径100 mm。实验时,阳极悬挂于待处理溶液上方,针尖到液面的距离为5mm,阳极和液面组成针- 面型放电结构。放电电流27 mA 左右,调压器电压保持在220 V。不加说明时待处理溶液的体积为100 mL。
1.2 仪器及试剂
试剂:番红花红T,无水Na2SO4,Fe2(SO4)3,FeSO4,均为分析纯;所用溶液均由去离子水配制。
仪器:TU-1901 型双光束紫外可见分光光度计,PHS-25 型pH 计,DDS-11D 型电导率仪,电子天平。
1.3 实验方法
用图1 所示实验装置对模拟废水进行放电处理,利用紫外- 可见分光光度计测量处理前后溶液在最大吸收波长处的吸光度,计算番红花红T 的降解效率η:
η=(A0-At )×100%/A0。
式中,A0和At分别为放电处理前和经过t 时间放电处理后溶液在最大吸收波长的吸光度。
当考察某一因素对降解效果的影响时,保持其他实验条件如放电电压、电流、电极间距以及待处理溶液的体积、初始含量等不变。
2 结果与讨论
2.1 番红花红T 的紫外- 可见吸收光谱
番红花红T 模拟废水的紫外- 可见吸收光谱随放电处理时间的变化如图2 所示。
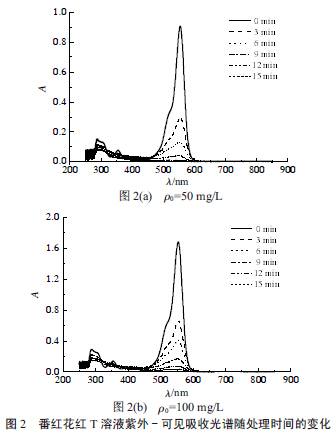
由图2 可知,番红花红T 在554 nm 处有一很强的吸收峰,且该吸收峰的强度随放电处理时间减小很快。该吸收峰就是番红花红T 发色团的最大吸收波长,由于阳离子处于共轭体系中使其最大特征吸收波长红移很多(绿光),放电处理使发色团的结构被破坏,因此吸光度随放电时间显著减小。仅放电3min,吸光度就下降了2/3 左右;放电15 min 后,吸光度已基本趋于0。说明辉光放电等离子体对阳离子染料番红花红T 的降解效果是很显著的,而且降解很彻底。300 nm 附近的宽带弱吸收为苯环的B 吸收带,由于吸收系数很小,强度很弱,同时该强度随放电处理时间的变化也很小,说明放电处理对发色团的破坏要强于对苯环的破坏。所以,用554 nm 处的吸光度来计算番红花红T 的降解效率。
2.2 降解效率
初始质量浓度分别为50 mg/L 和100 mg/L 的番红花红T 模拟废水在相同的实验条件下,降解效率随放电处理时间的变化如图3 所示。

由图3 可知,随着放电处理时间的延长,降解效率逐渐增加,15 min 时降解效率分别为99.34%(50mg/L)和98.99%(100 mg/L)。低含量模拟废水的降解效率略高于高含量模拟废水,但2 者的最大差别小于10%;而且低含量模拟废水在放电处理9 min时就接近完全降解(η≥95%),比高含量模拟废水提前大约4 min。
这样的结果是容易理解的,高含量的模拟废水所含的番红花红T 量多(是低含量的2 倍),而放电所产生的强氧化性物质有限,没有达到和低含量降解效率相等时所需要的量,因此,降解效率总是低于低含量模拟废水。但随着处理时间的延长,未降解的番红花红T 量越来越小,因此,降解效率的差别也就越来越小。从能量利用率来讲,对高含量模拟废水处理的能效要高于低含量模拟废水。
2.3 降解的动力学特征
为研究辉光放电等离子体降解番红花红T 的动力学过程,用554 nm 处测量初始质量浓度100 mg/L的不同放电时间的吸光度A,以ln (A0/At )为纵轴,以降解时间t 为横轴作图,结果如图4 所示。

由图4 可知,ln (A0/At )与降解时间t 有很好的线性关系(ln (A0/At )=0.253 1 min-1 t),其线性相关系数R2=0.997 1。表明辉光放电等离子体对番红花红T的降解遵循1 级动力学特性,且1 级动力学常数为0.253 1 min-1。此结果和许多文献的报导一致。
2.4 溶液电导率和pH 的变化
实验记录了不同放电时间溶液的电导率和pH的变化如图5 所示。

由图5 可知,溶液的电导率和pH 的变化趋势是不同的。随着放电过程的进行,溶液的电导率单调增大,pH 单调减小。在放电的初始3 min 变化最大,对初始质量浓度为100 mg/L 的模拟废水,电导率由35 μS/cm 突增至541 μS/cm,pH 由4.65 减到3.26;同样,对初始质量浓度为50 mg/L 的模拟废水,电导率由18 μS/cm 增至446 μS/cm,pH 由4.70 减到3.07。着放电时间的延长,电导率增加较快,而pH 的降低相对较慢。放电15 min 后,电导率为1 550 μS/cm(50 mg/L)和1 850 μS/cm(100 mg/L),pH 为2.56(50 mg/L)和2.71(100 mg/L)。说明在放电过程中,不断有带电离子和酸性物质产生,尤其是在番红花红T 大量降解的初始阶段。这样的实验结果与文献一致。
实验发现,溶液的电导率越小,酸性越强,降解效率越高。可能原因是溶液的电导率越大,放电电流就越大,消耗的能量就越多,相应地产生的活性氧化剂的量就少,从而使降解效率降低。至于酸性强,降解效率高很可能与羟基在酸性条件下的氧化作用强有关。
2.5 Fe3+ 和Fe2+对降解效率的影响
为了探讨辉光放电等离子体降解番红花红T 的主要因素,设计1 组对比实验,即在放电处理的同时,给溶液中加入一定量的Fe2(SO4)3、FeSO4和Na2SO4,对处理后的降解效率作对比分析来推测起降解作用的主要因素。
对体积100 mL 初始番红花红T 质量浓度100mg/L 的溶液分别加入不同质量的Fe2(SO4)3和FeSO4后进行放电处理10 min,结果见表1。
表1 Fe2(SO4)3和FeSO4加入量对处理番红花红T 溶液10 min 降解效率的影响
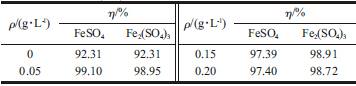
由表1 可知,加Fe2(SO4)3和FeSO4的模拟废水降解效率均有明显提高;而且加入量存在一个优化值,当加入量超过优化值时,降解效率稍有下降(但仍大于未加情况);同时发现加Fe2(SO4)3的降解效果要高于加FeSO4的降解效果。
向模拟废水中加入Fe2(SO4)3和FeSO4,也就是给溶液中提供了Fe3+、Fe2+和SO42-。先忽略SO42-对降解效率的影响(事实上它是抑制番红花红T 降解的,见2.6 节),先考虑2 种Fe 离子的影响。溶液中如果有H2O2存在,则Fe2+ 通过Fenton 效应能将H2O2转换为氧化性更强的羟基自由基(·OH):
Fe2++H2O2→·OH+OH-+Fe3+; (2)
Fe3+也能把H2O2转换为·OH[10]:
Fe3++H2O2→H++HO2·+Fe2+, (3)
HO2·+H2O2→H2O+O2+·OH。(4)
说明在辉光放电过程中,有氧化性物质·OH 和H2O2产生,由于·OH(氧化电位2.8V)的氧化性要强于H2O2 (氧化电位1.77 V),因此,·OH 较H2O2对还原性有机污染物的降解更有效更快速更彻底(因·OH的寿命短、反应速率常数大)。如果H2O2对番红花红T 的降解起主要作用,就不会在放电处理10 min后降解效率还有如此显著的提高(提高了5%~7%)。但加入量优化值的存在,可能是因为当放电所产生的H2O2几乎被Fe 离子都转化为·OH 时,多余的Fe离子和·OH 反应(见式(3)和式(5))就会削弱·OH对污染物的降解,即存在多余的Fe 离子和番红花红T 降解对·OH 的竞争。
Fe2++·OH→ OH-+Fe3+, (5)
至于加Fe3+ 较加Fe2+ 更有利于降解效率提高的原因,可能是在溶液中还发生了Fe3+ 转化为Fe2+ 的多种途径(见式(2)和式(5)),生成的Fe2+ 与H2O2快速反应产生·OH,即加Fe3+ 产生羟基自由基的效率高。
由反应式(2)~(5)也可看出,Fe2+ 也可以转化为Fe3+,这里就有一个反应速率和反应物含量的问题。可以推测由式(2)表示的化学反应较式(3)表示的反应更可能容易进行,即Fe3+ 可通过转化为Fe2+ 来产生·OH;反过来,Fe2+ 转化为Fe3+ 后,可能因为含量低或反应速率小而产生的·OH 量很小或很难产生。
实验时按纯物质的质量加,这2 种物质的相对分子质量不同,Fe2(SO4)3是399.82,FeSO4是151.92,但1 mol 的Fe2(SO4)3提供2 mol 的Fe3+,相同质量的FeSO4可提供约2.6 mol 的Fe2+,而相同量的2 种Fe离子产生相同量的·OH,这样应该是Fe2+ 的催化降解好,但实验结果是Fe3+ 的催化降解好。
2.6 Na2SO4对降解效率的影响
为了考察SO42- 对降解效率的影响,向体积100mL 初始质量浓度50 mg/L 的番红花红T 溶液中分别加入不同质量的Na2SO4,放电处理9 min 后得到的降解效率变化如图6 所示。
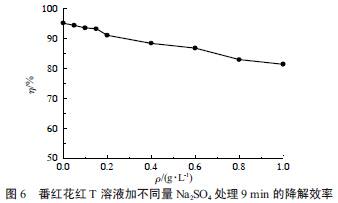
由图6 可知,加入Na2SO4后番红花红T 的降解效率降低,且加入Na2SO4的量越多,降解效率下降越多。给溶液中加入Na2SO4相当于提供Na+ 和SO42-,碱金属离子具有十分稳定的结构,只能被还原性更强的原子或基团所还原,因此,在溶液中Na+ 总是以1 价正离子的形式存在,不参与电子得失的化学反应。而SO42- 不同,它有可能和羟基发生氧化还原反应(见反应式(8))以降低番红花红T 的降解,这可能是造成降解效率下降的原因所在。这个结果和文献的报导是一致的。
SO42-+·OH→·SO4-+OH-。(6)
2.7 降解因素分析
综合2.5 节和2.6 节实验结果可知,在气- 液辉光放电过程中,有·OH 和H2O2氧化性物质产生[13-14]:
e*-+H2O→·OH+H·+e-, (7)
H2O+e*-→ H2O2+H2+e-。(8)
但对番红花红T 起降解作用的主要是·OH。对番红花红T 模拟废水仅放电处理10 min,降解效率达93%,快接近完全降解;仅加50 mg/L 的电解质处理后,降解效率就达到~99%,再考虑到SO42-对降解的拟制作用,说明Fe 离子把H2O2转化成·OH,使降解效率显著提高。因为·OH 的氧化电位高,寿命短(<0.1 ms),可以诱发一系列的链反应,是一种非选择性的氧化剂,可以有效降解难降解的有机污染物。在放电过程中,也可能有臭氧产生:
e+O2→ 2O+e, (9)
O+O2+M→ O3+M。(10)
当然,也不排除臭氧对番红花红T 的降解作用(但不会强过·OH 的作用[15])。因为臭氧也是一种强氧化剂,氧化电位2.07 V,它既可以直接作用于污染物使其降解,也可以通过紫外辐射转化为·OH 间接使污染物降解。有关这方面以及涉及降解机理的研究是后续要深入做的工作。。
3 结论
采用针- 面型接触式辉光放电等离子体对阳离子染料番红花红T 模拟废水进行了处理,染料废水的降解脱色效果十分显著。仅放电处理3 min,降解效率就达到60%以上;15 min 达到99%。而且实验装置简单、操作方便、成本低、便于应用。
在放电处理过程中,有氧化性物质·OH 和H2O2形成,对番红花红T 起降解作用的主要是·OH 自由基。随着放电处理过程的进行,溶液的电导率增加,pH 减小。电导率和pH 对番红花红T 的降解有影响,但很小。电导率很大时会影响放电形式,使辉光放电转化为火花放电,进而影响降解效果。向待处理的染料废水中加入适量Fe 离子有助于·OH 的产生,进而能有效提高降解效率,但SO42- 对降解有一定的抑制作用。
本研究对难降解有机染料废水的处理提供了一条可供借鉴的新方法,可作为有色废水深度处理的终端设备使其达标排放。














