1.引言
聚合硫酸铁(PFS)也称碱式硫酸铁或羟基硫酸铁,是一种无机高分子絮凝剂。与其他絮凝剂如三氯化铁,硫酸铝,氯化硫酸铁,碱式氯化铝等相比,聚合硫酸铁生产成本低、投加量少、适用PH范围广、杂质(浊度、COD、悬浮物等)去除率高、残留物浓度低、矾花沉降速度快、脱色效果好,因而广泛应用于工业废水,城市污水,工业用水以及生活饮用水的净化处理。
聚合硫酸铁(PFS)的生产方法多种多样,根据使用的氧化剂,可将制备方法大致分为空气氧化法、硝酸氧化法、氯酸盐和双氧水氧化法。但无论是哪种氧化剂,都是经过氧化、水解、聚合制得聚合硫酸铁(PFS)。本文用双氧水为氧化剂,直接氧化七水合硫酸亚铁合成聚合硫酸铁,探索了最佳合成条件。利用本法生产聚合硫酸铁,设备简单、生产周期短、无污染、反应不用催化剂、产品不含杂质、稳定性高,对工业化生产具有一定的指导作用
1 实验部分
1.1主要试剂及仪器
FeSO4.7H2O(AR)、H2O2(AR)、浓H2SO4
精密电动搅拌器、721型分光光度计、pHS-3C型酸度计、密度计等。
1.2实验方法
把七水合硫酸亚铁加入到三口烧瓶中加水溶解,在不断搅拌下,按一定比例滴加浓硫酸和双氧水,把得到的产品在一定温度下进一步熟化即可得到较高盐基度的红棕色聚合硫酸铁(PFS)。
2 结果与讨论
2.1实验原理
七水合硫酸亚铁在酸性条件下,被双氧水氧化成硫酸铁,经水解、聚合反应制得红棕色聚合硫酸铁(PFS)。主要反应如下:
(1)氧化反应
(2)水解反应
(3)聚合反应
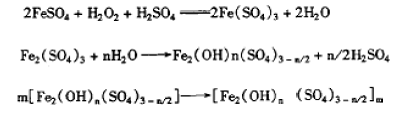
氧化、水解、聚合3个反应同时存在于一个体系当中,相互影响,相互促进。其中氧化反应是3个反应中较慢的一步,控制着整个反应过程。
2.2 H2SO4 用量的影响
常温下,30g FeSO4.7H2O、30 ml水,滴加浓硫酸和9mlH2O2。结果如表1所示。
表1 H2SO4 用量对产品性能的影响
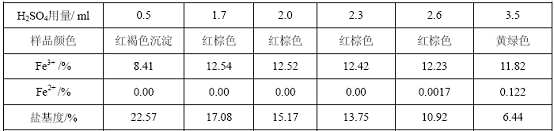
硫酸在聚合硫酸铁的合成过程中有两个作用:①作为反应的原料参与了聚合反应;②决定体系的酸度,其用量直接影响产品性能。由表1可知,硫酸用量适当增加对提高合成反应是有利的。但硫酸用量太大,亚铁离子氧化不完全,
样品颜色由红褐色变为黄绿色,且大部分铁离子没有参与聚合,导致盐基度很低,合成失败;硫酸量不足,量越少,生成Fe(OH)3趋势越大,即溶液中[OH-]相对较大。当硫酸与Fe2+的物质的量之比为0.15~0.30时减少硫酸用量可显著提高产品盐基度,但当该比值小于0.15时,会产生大量的Fe(OH)3凝胶沉淀,最终导致产品铁含量大幅度降低,同时因溶液中存在相对较大[OH-]
,使测得的产品盐基度偏高,但这并非铁离子高度聚合的反映。实验表明:只有当硫酸与Fe2+的物质的量之比介于0.30~0.45之间时,聚合硫酸铁产品性能最好。硫酸用量1.7
ml时盐基度较大,为此本实验条件下浓硫酸用量1.7 ml。[1,2]
2.3 H2O2用量的影响
常温下,30g FeSO4.7H2O、30 ml水、1.7 ml浓H2SO4,用漏斗滴加不同量H2O2,测定Fe2+转化率,Fe2+的转化率越高,反应所得的产品质量越好,可用Fe2+的转化率衡量合成反应,以下相同。
表2 H2O2用量对Fe2+转化率的影响
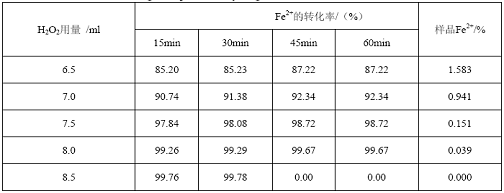
H2O2的用量对产品质量指标有很大的影响,当H2O2加入不足时,Fe2+不能够完全氧化Fe3+,此时溶液中仍然含有较多的Fe2+;加入量过多时,固然可以保证氧化完全,但引起氧化剂不必要的浪费。由表2可以看到H2O2的用量为8ml时,样品中Fe2+氧化比较完全。因此H2O2的用量定为8.0
ml。
2.4 H2O2 加入速度
为了保证氧化反应的进行,必须控制氧化剂加入的速度,在搅拌作用下使物料之间充分接触反应。但若加入速度过慢,反应所需时间过长,对工业生产是不利的。若加入速度过快,氧化剂有可能来不及与物料充分接触反应就被分解。因此本实验在常温下,
漏斗插入液面以下将H2O2慢慢滴入,控制H2O2加入量约为每分钟1.0ml。
2.5反应温度的影响
30g FeSO4.7H2O、30 ml水、1.7 ml浓H2SO4、8 .0mlH2O2。改变温度测定Fe2+转化率。
表3 不同温度下Fe2+的转化率
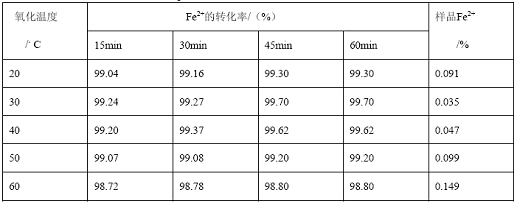
用滴加的方式加入H2O2,由于反应放出大量热,温度对Fe2+的转化率影响不明显。但在温度较低时,七水合硫酸亚铁很难溶解,延长了反应时间,同时Fe2+的转化率稍有降低在
温度较高时,会引起H2O2部分分解,使溶液中含有较多的Fe2+。所以把温度控制在20℃—30℃(常温)即可。
2.5 搅拌速度及搅拌时间的影响
30g FeSO4.7H2O、30 ml水、1.7 ml浓H2SO4、8 .0mlH2O2,常温反应用量条件下,检测不同搅拌速度及搅拌时间下Fe2+的转化率。
表4 不同搅拌强度及搅拌时间下Fe2+的转化率
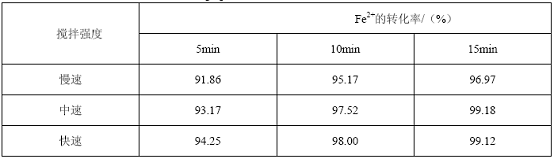
此反应在搅拌作用下,使氧化反应均匀快速进行。由表4可看到,搅拌速度小,H2O2没有及时分散,会造成局部氧化及H2O2分解,从而导致Fe2+不能够完全氧化;若搅拌速度大,溶液飞溅,不仅增加能耗且氧化不均匀。反应在15分钟时Fe2+已基本氧化,故采用中速搅拌15分钟。
由表5可知,反应时间不同会影响产品性能。70。C水浴加热使水分蒸发溶液浓缩同时增强聚合效果。反应时间越长,产品性能越好,但是4.0 h后,产品性能改变很小,继续延长反应时间,只能增加能耗,降低生产效率;反应时间太短,不能够完全生成碱式硫酸铁,从而影响聚合效果,致使产品的盐基度过低。
2.6产品质量
密度、,Fe3+、Fe2+、PH(1%水溶液)、盐基度的测定见参考文献[4,5,6]。本实验方法制备的产品质量如表5。
表5 产品指标
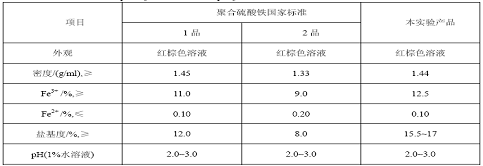
通过与聚合硫酸铁国家标准对照,本实验方法制得的产品力量达到了国标1级要求。
3 结论
(1)在常温常压条件下,采用双氧水作为氧化剂能合成较为理想的聚合硫酸铁产品。具有备投资小,生产周期短,工艺流程简单及生产效率高的特点,且生产无二次污染为绿色化工工艺,适合中小型企业投资生产。
(2)硫酸用量是决定产品质量的关键。在实验范围内,增加硫酸用量显著提高产品性能,当硫酸与Fe2+的物质的量之比介于0.30~0.45之间时,产品性能良好。
(3)H2O2的用量对产品质量也有很大的影响,用滴加的方式加入H2O2,保持一定滴加速度,可节约用量。
(4)在适当搅拌强度下,由于反应放出大量热,温度对反应影响不明显,可在常温常压条件下合成合格产品。
(5)反应在70。C水浴加热对合成有较大影响,反应时间越长,产品性能越好,但时间过长只能增加能耗及降低生产效率。综合考虑,恰当的反应时间为4h左右。














