[拼音]:xiaosuan
[外文]:nitric acid
化学式HNO3。无色透明油状液体,重要的工业三酸之一,也是实验室常用的试剂。
物理性质纯硝酸熔点-42°C,沸点83°C,相对密度1.5027;受光照会缓慢分解变黄。市售硝酸的浓度为15M,含HNO3 68%~70%,密度1.42克/厘米3,能与水任意混合。溶解过量二氧化氮(含HNO3 86%~97.5%以上) 的浓硝酸呈棕黄色,在空气中猛烈发烟并吸收水分,称发烟硝酸。
化学性质浓硝酸有强氧化性,能将一般金属(除金、铂外)氧化成氧化物或硝酸盐,将单质磷氧化成磷酸,单质硫氧化成硫酸,将有机物或碳氧化成二氧化碳。有强腐蚀性,能严重烧伤人体肌肤。纯硝酸在沸点时发生分解:
4HNO3─→4NO2+ O2+2H2O-62kcal
硝酸一般可还原成NO,浓硝酸常可还原成NO2,活泼金属可将稀硝酸还原成铵盐。
硝酸是强酸,在水溶液中完全电离成H+和硝酸根离子,但由于其氧化性,不能用金属从稀硝酸中置换氢。
制法主要是氨的催化氧化:
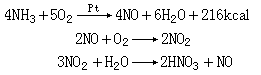
溶解时产生的NO可再经氧化变成硝酸,反应生成的50%~70%的硝酸经硫酸脱水、蒸馏即可得90%~100%的浓硝酸。硝酸盐与浓硫酸反应,是实验室制备少量硝酸的一种方法:
NaNO3+H2SO4─→HNO3+NaHSO4
硝酸可从反应物中馏出。
应用硝酸与氨水中和,形成无色晶状的硝酸铵,含氮34%~35%,比一般氮肥高出约一倍。硝酸能使甘油和甲苯硝化,生成易爆的硝化甘油和三硝基甲苯,是应用广泛的炸药。纤维素硝化可制硝化纤维。