[拼音]:rehuaxue shuju
[外文]:thermochemical data
与物理和化学变化的热效应有关的基础数据,通常指热容、相变热、化学反应热和混合热等,是化工热力学研究的一类基础数据,在热力学分析计算和工程设计方面有着广泛的应用。
热容指没有相变化和化学变化时,一定量均相物质温度升高1K所需的热量。如果是1mol物质,则所需热量即为摩尔热容。在等压条件下的摩尔热容Cp,称为定压摩尔热容。在等容条件下的摩尔热容Cv,称为定容摩尔热容。通常将定压摩尔热容与温度的关系,关联成多项式。多项式中的系数,与物性、相态及温度范围有关,刊在有关手册之中。
相变热指物质在相变化过程中吸收或释放的热量,主要有:
(1)蒸发热,由液相变为汽相时的相变热;
(2)熔化热,由固相变为液相时的相变热;
(3)升华热,由固相直接变为汽相时的相变热。在化工中,蒸发热最常用。
确定相变热常用的方法有两种:
(1)直接量热。例如在等压(压力等于饱和蒸气压)下测定一定量液体蒸发所需的能量,算出蒸发热。
(2)先测量不同温度下的饱和蒸气压,然后用克劳修斯-克拉珀龙方程(见蒸气压方程)计算蒸发热。许多物质的相变热数据刊在有关手册中,也可用经验式计算。其中蒸发热数据已较完备,经验式的精度也较高。
计算蒸发热常用里德尔式:
ΔHV=1.093RTb(lnpc-1)/(0.930-Tbr)
Tbr=Tb/Tc
式中ΔHV为正常沸点下的蒸发热;R 为摩尔气体常数;Tb和Tc分别为正常沸点温度和临界温度;pc为临界压力(kg/cm2)。此式预测误差不大于2%。计算蒸发热还常用沃森式:
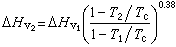
式中下标1和2分别表示两个不同温度。此式用于从某一温度下的蒸发热计算另一温度下的蒸发热。
熔化热不但取决于温度,还同固相的晶形有关,因而缺乏通用的计算方法。对于单原子物质,可用下式估算:
ΔHm=RTm
式中ΔHm为熔化热;Tm为正常熔点;R为摩尔气体常数。
升华热一般可以看作是熔化热与蒸发热之和。
化学反应热简称反应热,是等温下化学反应释放或吸收的热量。反应热原则上可用两种实验方法测定:
(1)用量热计直接测量,例如使反应在绝热的密闭容器中进行,通过能量衡算便可算出反应热;
(2)先测定不同温度下的反应平衡常数,然后用关联反应热、反应平衡常数和温度的热力学公式计算反应热。对于难以控制和测定其反应热或平衡常数的化学反应,可根据1840年Γ.И.盖斯所提出的盖斯定律(化学反应或物理变化的热效应与其途径无关),利用生成热(恒温时由最稳定的单质化合成1摩尔某种化合物时焓的变化)或燃烧热(1摩尔某物质完全燃烧时焓的变化)间接计算。具体计算式如下:
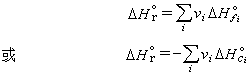
式中ΔH嬼、ΔH媗和ΔH婱分别为反应热、i物质的生成热和i物质的燃烧热;上标“°”表示与反应有关的物质均处于热化学标准态(气体是压力为101.325kPa的理想气体状态,液体和固体是压力为101.325kPa的纯液体和纯固体),vi为反应方程中i物质的计量系数,i为反应物时其值为负,为产物时其值为正(见化学计量学)。许多物质的燃烧热和生成热数据刊在有关手册中。
混合热不同物质在恒温、恒压下混合时吸收或释放的热量。理想气体混合时不产生混合热。低压气体的混合热很小,可忽略不计。某些结构相近的液体(如甲苯和苯),混合热也很小。对于高压气体和结构差别大的液体,混合热就须考虑。混合过程有时和反应过程相似,两者间很难严格区分,例如盐酸水溶液和氢氧化钠水溶液的混合热,实际上是氢离子与氢氧根离子化合成水的反应热。气体、液体和固体溶于溶剂中形成溶液时的混合热,通称溶解热。溶解热数据主要有四种类型:
(1)积分溶解热,即1摩尔溶质溶解于一定量溶剂中,形成一定浓度的溶液所吸收或释放的热量;
(2)微分溶解热,即1 摩尔溶质溶于大量一定浓度的溶液中而不改变溶液浓度时所产生的热效应;
(3)积分稀释热,为含有1摩尔溶质的溶液,从某一浓度稀释至另一浓度时的热效应;
(4)微分稀释热,指在大量一定浓度的溶液中,不改变溶液浓度时,每加入1摩尔溶剂所产生的热效应。