[中图分类号]X703.1[文献标识码]B[文章编号]1005-829X(2009)07-0051-03
钒是优良的合金元素,广泛用于汽车、机械、铁路等行业。但是,许多钒的化合物都有毒性,其中钒(Ⅴ)的化合物毒性最大,钒只能够微量存在于人体中,人体如果吸入过多的钒,可刺激呼吸、消化及神经系统,也可损害皮肤、心脏和肾脏,还可抑制三磷酸腺苷酶及磷酸酶的活性,使皮肤出现炎症并引起变态性疾病〔1〕。随着钒工业的发展,含钒废水更多地污染地下水,影响人类健康。因此,对于含钒废水的治理刻不容缓。
目前,国内外治理含钒废水的方法有〔2-8〕:化学沉淀法、离子交换法、萃取法、电解法、活性炭吸附法、厌氧及好氧生物法。工业上对于含钒废水的处理主要采用化学沉淀法和离子交换法。其中还原中和法在工业上应用最为广泛,所用还原剂有:硫酸亚铁、铁屑、粒铁〔9〕、废熔盐〔10〕、二氧化硫〔11〕、亚硫酸钠、焦亚硫酸钠、亚硫酸氢钠〔12〕。中和剂有:NaOH、石灰〔13〕、Na2CO3。含钒废水大部分为酸性,钒质量浓度一般在0.2g/L以下〔14〕。目前关于高浓度含钒碱性废水的处理尚未见报道。笔者采用硫酸亚铁还原—氢氧化钠中和法处理高浓度碱性含钒废水,探讨了其最佳工艺条件,并采用投加助凝剂的方法对其沉降速度慢、沉渣量大的缺点进行了改进。
1.实验部分
试剂:七水合硫酸亚铁、硫酸、氢氧化钠、PAM(阴离子型)、硫酸亚铁铵、高锰酸钾、亚硝酸钠、磷酸、浓盐酸、重铬酸钾、尿素、硝酸、苯代邻氨基苯甲酸、二苯胺磺酸钠,均为国产分析纯试剂。废水取自某厂的催化剂冲洗液,溶液呈浅黄绿色,pH为9,含有9.5g/LV5+,10%BO33-,5%CO32-,16.5g/LK+,12.3g/LNa+及少量有机物,有机物由红外分析得出含有还原性基团:炔基和醇羟基。
2.结果与讨论
本实验采用离子交换法、活性炭吸附法、钡盐沉淀法、还原—中和—絮凝法对废水进行了处理。离子交换法处理高浓度含钒废水不经济,需消耗大量树脂;钡盐沉淀法处理效果虽好,但溶液中存在的CO32-也会与Ba2+反应生成沉淀,需消耗大量钡盐,而且钡盐来源少、价格高;而活性炭吸附法处理成本较低,但处理结果不令人满意。实验结果得出最经济、效果最好的方法是还原—中和—絮凝法。
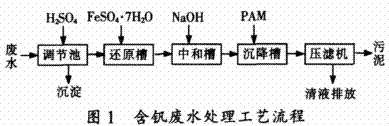
2.1还原—中和—絮凝法工艺原理与流程
在酸性条件下,高价钒是强氧化剂,可以被硫酸亚铁及有机还原性基团炔基和醇羟基还原成V(Ⅳ)和V(Ⅲ),此时部分Fe2+被氧化成Fe3+,Fe3+能与高价钒反应生成组成不定的钒酸铁沉淀。V2O5被还原成VO2后生成VO2.xH2O水合物沉淀〔15〕。然后将废水pH调至9时,生成带正电荷的Fe(OH)2和Fe(OH)3沉淀。它们是新生成的活性絮凝剂,能与钒酸铁共沉淀,并能吸附游离的钒离子,但易发生胶体再稳现象,而沉淀缓慢。当加入与之带相反电荷的PAM阴离子型絮凝剂时,可使颗粒表面的动电位下降而凝聚。同时,PAM絮凝剂还能通过桥连和网捕作用来减少沉淀体积,加快沉降速度〔16〕,从而达到提高处理效果的目的。工艺流程见图1。
2.2还原剂用量对还原过程的影响
取废水100mL,加20%硫酸至pH为1.9,抽滤,按n(Fe)∶n(V)加入不同量的FeSO.47H2O,室温下搅拌30min,用20%的NaOH调pH至9,继续搅拌30min,静置,处理结果见表1。

由表1可见,随着硫酸亚铁用量的增加,出水中钒含量逐渐减少,n(Fe)∶n(V)=4时处理效果最佳。
2.3pH对还原反应的影响
取废水100mL,加20%硫酸调节废水至不同的pH,抽滤,按n(Fe)∶n(V)=4∶1加入FeSO4.7H2O,室温搅拌30min后,用20%NaOH调pH至9,继续搅拌30min后静置,考察还原pH对出水中钒残留量的影响,结果见表2。

由表2可以看出,废水酸性越强,出水中钒的残留量越少,废水pH为1.0时,钒的去除率最高。这是因为废水酸性越强,在相同时间内还原反应进行得越完全。当废水pH调至碱性时,钒酸铁与反应生成的氢氧化铁同时沉降被除去。但酸性太强,调节废水还原pH需要消耗大量的酸,再调节废水pH进行中和沉淀时,又要消耗大量的碱,当pH为2.0时,再降低pH,出水中钒残留量减少得较缓,因而调还原pH至2为宜。
2.4反应时间对还原过程的影响
取废水100mL,加20%的硫酸调废水pH为2,抽滤,按n(Fe)∶n(V)=4∶1加入FeSO4.7H2O,室温下搅拌不同时间后,用20%的NaOH调pH至9,继续搅拌30min后静置,考察还原反应时间对出水中钒残留量的影响,结果见表3。

从表3可以看出,还原反应时间越长,出水中钒残留量越少,但还原反应时间越长,废水处理负荷将变少,且要消耗机械搅拌的电能,使处理成本增加;且当还原反应时间>30min时,出水中钒残留量减少得较缓,因此,选择还原反应时间为30min。
2.5pH对中和沉淀过程的影响
取废水100mL,加20%的硫酸调废水pH为2,抽滤,按n(Fe)∶n(V)=4∶1加入FeSO4.7H2O,室温搅拌30min,用20%的NaOH调废水至不同pH,继续搅拌30min后静置,考察中和pH对出水中钒残留量的影响,结果见表4。

从表4可以看出,随着中和pH的增大,出水中钒的残留量越少,当pH>9时,出水中钒残留量减少得较缓。这是因为Fe2+开始沉淀时,pH为6.64,完全沉淀pH为8.90,因而pH<9时,随着pH增大,Fe2+沉降得越快,与其共沉淀的钒越多,出水中钒的残留量越少;当pH>9时,Fe2+沉降完全,再增大pH对之影响很小,且会增加处理费用,因而选择中和pH为9。
2.6助凝剂对沉降过程的影响
上述试验结果表明,该废水经还原—中和处理后不能达到国家一级排放标准(V质量浓度<0.001g/L),需要进一步处理。实验发现,100mL的废水经还原—中和处理后,需静置2h以上,才能使沉淀完全沉降,上层液清澈。且生成的沉淀疏松,体积大,固液分离困难。本实验选择投加絮凝剂的方法来改善上述情况。PAM阴离子型絮凝剂能对带正电荷的重金属氢氧化物沉淀起絮凝作用,使小颗粒沉淀物形成较大的颗粒,并可加速沉降和固液分离。按文献〔16〕的方法配制并投加4mg/LPAM阴离子型絮凝剂。其他条件不变,结果发现:静置沉降25min后,上层溶液完全澄清,沉淀颗粒变大,沉淀体积也减少了一半。用大孔滤纸过滤后溶液为无色。
2.7优化条件重复实验
综上所述,废水处理较适宜的条件是:还原pH为2,还原时间30min,n(Fe)∶n(V)=4∶1,中和pH至9,搅拌,助凝剂投加质量浓度为4mg/L。为了验证试验的重现性,采用该条件进行重复试验,结果见表5。

由表5可知,在最优条件下,多次重复试验证明,实验重现性好,处理后的废水中钒质量浓度降至0.001g/L以下,pH7~9,水无色,完全达到国家废水排放标准要求。
3.结论
(1)采用硫酸亚铁沉淀—氢氧化钠中和—PAM絮凝法处理高浓度含钒碱性工业废水,工艺技术可行,处理后水中钒含量达到国家排放标准要求。
(2)最优工艺条件:还原反应pH为2,还原反应时间为30min,FeSO4.7H2O按n(Fe)∶n(V)=4∶1投加,中和沉淀反应pH为9,室温搅拌,助凝剂投加质量浓度为4mg/L。
(3)投加阴离子絮凝剂PAM可加速沉降,增大沉淀颗粒,沉淀体积减少了一半。














