微生物絮凝剂是一种新型的天然有机高分子絮凝剂,它具有絮凝效率高,易被微生物降解,无毒无害,安全性高,无二次污染等特点。目前,微生物絮凝剂用于水处理领域的最大障碍是用量大、成本高。因此,寻找高效絮凝剂产生菌,提高絮凝活性,降低培养基的成本已成为絮凝剂能否在工业中得到推广应用的关键所在。
目前国内外对微生物絮凝剂廉价培养基作了大量的研究。大连理工大学的周旭在培育假单胞菌时,利用鱼粉废水生产出了性能良好的微生物絮凝剂PSD-1。李剑利用乳品废水培养菌GL-3产生的生物絮凝剂对多种实际废水也有良好的净化效果。张志强的研究(复合菌群产微生物絮凝剂的研究.南昌大学学位论文,2005.)表明,啤酒废水完全可以取代葡萄糖作为其构建的絮凝剂产生菌群的碳源和能源。Fujita以低分子量的挥发性脂肪酸如乙酸、丙酸作为碳源对絮凝剂产生菌Cirtobacterisp进行培养,生产絮凝剂,以降低生产成本,因为这些物质可以很方便地从各种有机废水中得到。
本研究利用淀粉废水生产微生物絮凝剂,并对菌株NⅢ2的最佳培养条件和最佳絮凝条件进行了研究,期为其工业化生产的实践提供依据。
1.实验材料与方法
1.1 实验材料
1.1.1 菌种
菌株NⅢ2,从污水厂的活性污泥中分离得到。
1.1.2 培养基
牛肉膏蛋白胨培养基:牛肉膏3.0g/L,氯化钠5.0g/L,蛋白胨10.0g/L,pH7.2。
微生物絮凝剂发酵培养基:磷酸二氢钾0.2g,磷酸氢二钾0.5g,尿素0.59g,NaCl0.1g,MgSO40.2g,淀粉废水1000mL,pH7.0。
1.2 实验方法
1.2.1 菌悬液制作方法
取100mL富集培养基于250mL锥形瓶中,用8层纱布封口,112.3℃、110kPa下水蒸气灭菌30min。无菌条件下接入菌株NⅢ2,于恒温振荡器中培养24h。培养液离心,倒去上清液并用缓冲溶液(pH=7)清洗沉淀3次,再用相同缓冲溶液制成OD600nm(光密度)值为1.8的菌悬液。
1.2.2 絮凝剂发酵培养方法
取发酵培养基100mL于250mL锥形瓶中,无菌操作条件下,加入2mL菌株NⅢ2的菌悬液接种于其中,30℃,160恒温振荡器好氧培养24h,然后在10000r/min下离心10min,上清液即为微生物絮凝剂粗品。
1.2.3 絮凝剂活性测定
在100mL含5g/L的高岭土的悬浊液中,加入定量1%的CaCl2溶液作为助凝剂,再加入微生物絮凝剂,调节pH值,然后快速搅拌1min,慢速搅拌5min,静置10min,用722型分光光度计在550nm处测定静止后的上清液吸光度,用下面的公式计算待测样品的絮凝率:
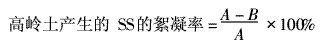
式中:A———对照上清液的吸光度;B———样品上清液的吸光度。
1.2.4 培养条件对微生物絮凝剂生产的影响
1.2.4.1 淀粉废水预发酵方法
(1)25℃淀粉废水加酒粬预发酵(碳源1),再加菌株NⅢ2菌悬液;
(2)淀粉废水不预处理(碳源2),同时加酒曲和菌株NⅢ2的菌悬液;
(3)淀粉废水不预处理(碳源2),直接加菌株NⅢ2的菌悬液;
(4)淀粉废水不预处理(碳源2),直接加酒曲。
1.2.4.2 淀粉废水COD浓度对微生物絮凝剂生产的影响
在氮源为尿素的条件下,分别将淀粉废水培养液的COD浓度调至8000、10000、12000、15000、17000mg/L,培养24h后,取样测定其絮凝率。
1.2.4.3 不同氮源对微生物絮凝剂生产的影响
在淀粉废水COD浓度为12000mg/L的条件下,分别以尿素、硫酸铵、硝酸铵、硝酸钾为氮源,连续培养24h后,取样测定絮凝率。
1.2.5 絮凝条件对絮凝活性的影响
分别测定不同的絮凝条件(pH值、絮凝剂投加量和氯化钙投加量)在不同情况下培养液对高岭土悬浮液的絮凝值,画出絮凝率的曲线图,分析各个絮凝条件对培养液絮凝的影响。
2 结果与分析
2.1 培养条件对微生物絮凝剂生产的影响
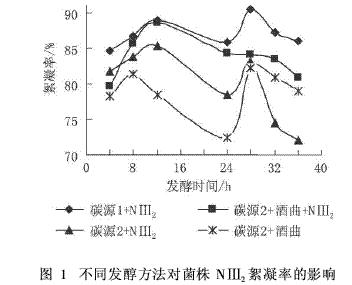
2.1.1 淀粉废水预发酵方法的确定
按照实验方法中的淀粉废水的预发酵方法进行实验,生产微生物絮凝剂,培养液为液态絮凝剂粗品,测定絮凝剂对水样中SS的去除率。
由图1可知,用酒曲对淀粉废水进行预发酵,之后再加入菌株NⅢ2的菌悬液生产微生物絮凝剂时,絮凝率基本为85%~95%,而且产生的矾花大,絮体生长速度快,短时间内使混浊液变清澈;而其他三种发酵方法,淀粉废水未预发酵作为碳源时,絮凝率为70%~90%,产生的矾花细小,生长速度慢,絮凝后的液体仍然混浊。因此,以淀粉废水作为碳源生产微生物絮凝剂应该进行适当的预发酵,以使淀粉大分子转化为其他小分子糖类,有利于微生物吸收利用。
2.1.2 淀粉废水COD浓度对微生物絮凝剂生产的影响
菌株NⅢ2在不同浓度的发酵液中培养后,对高岭土悬浊液的絮凝效果见图2。
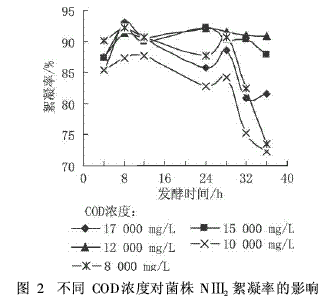
由图2可知,当培养液的COD浓度为12000mg/L和15000mg/L时,生产出的微生物絮凝剂的絮凝效果比较稳定,特别是当培养时间在24~28h时,絮凝率都在90%以上;当COD浓度为10000mg/L和8000mg/L时,絮凝效果比较差,而且到培养后期絮凝率明显呈下降趋势;当COD浓度为17000mg/L时,絮凝效果也不稳定,并且在实验中还发现,当培养基中COD浓度过高,随培养时间的增加,培养基呈现黄色,使处理后的水有颜色。这是因为碳源浓度对絮凝剂的产生有很大影响。碳源浓度过低,不能提供足够的能量和物质来源;在培养基中加入过量碳源,会使处于停止期的细胞获得活力,细胞数量增殖上升结果降低了絮凝活性。
所以在本实验条件下,菌株NⅢ2适合利用COD浓度为12000mg/L和15000mg/L的淀粉废水为碳源生产微生物絮凝剂,再从减少培养基用量能使絮凝效果达到最佳的角度考虑,认为COD为12000mg/L是最适宜的。
2.1.3 不同氮源对微生物絮凝剂生产的影响
氮是构成微生物细胞蛋白和核酸的主要元素,真菌对无机氮源和有机氮源有一定的选择性,氮源的类型不同则真菌对其利用的程度也不同。不同氮源对菌株NⅢ2絮凝性影响实验结果见图3。
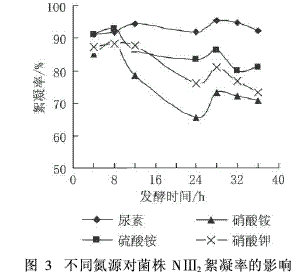
由图3可知,以尿素为氮源时,絮体形成快、矾花大、沉降速度快、上清液清澈,其絮凝率都在90%以上,絮凝效果最好;当以硫酸铵为氮源时,絮凝率大多都在80%~90%之间;以硝酸铵和硝酸钾为氮源时,絮凝效果均不太理想。可见对于菌株NⅢ2来讲,有机氮比无机氮更有利于絮凝剂的合成,因此选择尿素为菌株NⅢ2生产微生物絮凝剂的最佳氮源。
2.2 絮凝条件对絮凝活性的影响
2.2.1 絮凝剂投加量对絮凝活性的影响
絮凝剂作为絮凝体系的主体,其投加量的多少直接关系到最终的絮凝效果,同时也是评价絮凝剂性能的重要指标。在100mL浓度为5g/L的高岭土悬浊液中加入2mL助凝剂(含10%的CaCl2)和不同体积的絮凝剂,保持絮凝体系的pH值为7.0,考察絮凝剂投加量对絮凝效果的影响,结果见图4。
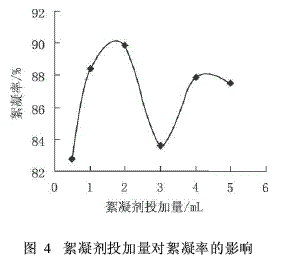
由图4可知,絮凝剂投加量为0.5~3mL时,絮凝率先增大后减少,为2mL时絮凝率达到最大(90.58%),再增加絮凝剂的投加量,絮凝率都没有显著升高,且絮凝剂的消耗加大,成本相应提高。因此絮凝剂的最佳投加量不是越多越好,在试验条件下,絮凝剂的最佳投加量为2mL。
2.2.2 CaCl2投加量对絮凝活性的影响
微生物絮凝剂是高分子物质,金属离子可以加强微生物絮凝剂的桥联作用和中和作用。Ca2+是一种良好的助凝剂,本实验选用CaCl2的质量分数为10%,菌株NⅢ2培养1天后的培养液2mL,pH调至7.0,测定高岭土悬浊液的絮凝率。
如图5所示,在不投加CaCl2时,高岭土悬浊液的絮凝率只有82%,絮凝率最高值89%出现在CaCl2投加量为2mL时,此后CaCl2投加量继续加大,絮凝剂的絮凝效果变化稳定,絮凝率没有明显改善。由此可见,CaCl2对絮凝效果有促进作用,最佳投加量为2mL。

2.2.3 pH值对絮凝活性的影响
在100mL浓度为5g/L的高岭土悬浊液中加入2mL絮凝剂和2mL助凝剂(含10%的CaCl2),改变絮凝体系的pH,考察絮凝体系pH对絮凝率的影响,结果见图6。
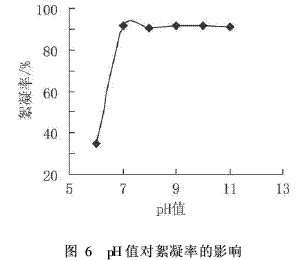
由图6可以看出当高岭土悬浊液的pH值为酸性时,基本没有絮凝效果,pH值为碱性时,絮凝率都在90%左右。这说明絮凝体系的pH值变化对絮凝剂的絮凝效果有很大的影响,pH值的变化影响絮凝剂的表面电荷性质,形态结构,从而影响到絮凝剂与悬浮颗粒之间的相互作用。因此,实验时选择合适的pH值,既可以节省大量的絮凝剂,还可以使絮凝效果达到最好。由图6可知,絮凝体系pH值为7时,絮凝效果最佳。
3 结论
(1)利用淀粉废水生产微生物絮凝剂时,淀粉废水要经过相应的预处理,才有利于微生物吸收利用。本研究确定了淀粉废水的预发酵方法,提高了微生物生产絮凝剂的效率。
(2)菌株NⅢ2生产微生物絮凝剂的培养条件是:淀粉废水COD浓度12000mg/L,尿素为最佳氮源。
(3)微生物絮凝剂的最佳絮凝条件是:在pH值为7.0,高岭土浓度为5g/L的100mL悬浊液中,絮凝剂投加量为2.0mL,CaCl2投加量为2.0mL。此时,絮凝效果最佳。














