[拼音]:danguchun
[外文]:cholesterol
环戊烷多氢菲衍生物,固醇的一种,构成细胞膜及其他生物膜的重要成分,也是体内转变成皮质固醇类激素、性激素的前体;7-脱氢胆固醇经紫外线照射可转变为维生素D3,这是晒太阳预防佝偻病的机理。众所周知,高血浆胆固醇是发生心血管疾病的风险因素,所以胆固醇成为固醇类化合物中最著名的成员。胆固醇在肝脏可转变为胆汁酸,再经胆道、胆囊排入肠腔;胆汁酸既是胆固醇排泄出体外的形式,也是肠道消化吸收脂类食物的必要物质。胆固醇既可从食物中摄取,也可在体内合成;肝脏可从乙酸活化物即乙酰辅酶A合成胆固醇并将其运送给其他组织;小肠等其他组织也有合成胆固醇的能力。胆固醇或游离存在或与脂肪酸结合成酯存在。胆固醇和胆固醇酯以脂蛋白形式运输,各种脂蛋白所含胆固醇的量不一,以低密度脂蛋白含量最高。生物膜中的胆固醇可以调整膜的流动性以适应不同的功能要求。胆固醇在体内各组织中分布不一,富含细胞膜的髓鞘含胆固醇量很高,所以脑及神经组织胆固醇最丰富,肝脏、小肠等脏器含量也不少。作为食物,动物的上述脏器组织以及家禽类卵黄含胆固醇量高。植物不合成胆固醇,不含胆固醇,所以植物食品是无胆固醇的。胆固醇是包括人类在内的所有动物所不可缺少的成分,但是胆固醇代谢异常又与疾病相关。由于尚未了解清楚的原因,胆固醇可以大量沉积在动脉管壁上,致管腔狭窄,是为动脉粥样硬化。胆汁中胆固醇过量或胆固醇与胆汁酸和卵磷脂的比例失调都可形成以胆固醇为主的胆石症,这多见于饮食过多的肥胖者。
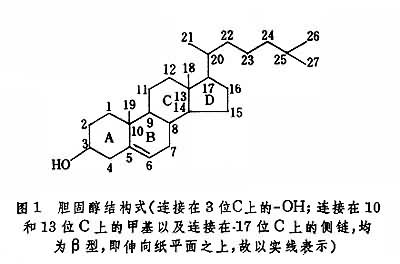
胆固醇的化学结构胆固醇是由 A、B和C等三个六碳环和一个五碳环D合并而成的环戊烷多氢菲衍生物,共含27个碳原子(图1)。环间相互以反式连接,通常取稳定的椅式构像。胆固醇除在5及6位碳之间有双键外,其余的碳多为氢所饱和(故称“多氢”)。各个碳原子的编号如式上所示,式中按惯例略去氢原子,CH3基也只以短线表示,如18、19、21、26和27位碳甲基。3位碳上有一个羟基,17位碳上是1条八碳侧链。环戊烷并菲核心为板状刚性结构,在其上的一端是具挠性的八碳侧链,而在其另一端是羟基。
 膜中胆固醇
膜中胆固醇
生物膜的基本结构是脂双层,即主要由磷脂分子构成的两层结构。磷脂是两性分子,含有亲水的头部(磷酸根及接连在磷酸根上的胆碱、乙醇胺、丝氨酸或肌醇等基团)和疏水的烃链。以细胞膜为例,一层磷脂分子的头部接触细胞膜外侧水相,它的疏水烃链对向另一磷脂分子层的烃链,后一分子层磷脂的亲水头部则面向细胞内的水性环境。总之,磷脂的亲水头部处于脂双层外面,与水相接触,而其疏水的烃链被裹在内。生物膜基本上是具有流动性的脂双层镶嵌着各种不同的可流动的蛋白质。胆固醇具有亲水性的羟基,具有疏水性的侧链和其他部分,也是两性分子。胆固醇具两性分子特性,参与构成生物膜,并在其中起重要作用。如前所述,生物膜是一种流动镶嵌结构,生物膜的各种功能与其流动性相关。一些原生生物以改变磷脂中脂肪酸的长度和饱和度来调节流动性以适应温度等的环境变化。在真核细胞,胆固醇是调节生物膜流动性的重要因素。它以其长轴与膜平面垂直插入脂双层,其羟基与亲水性的磷脂头部羰基氧原子形成氢键,其具有挠性的烃链置于脂双层疏水性核心中。胆固醇若插到磷脂的胞和烃链中间就阻碍这些烃链相互紧密规则排列,从而增加膜的流动性。胆固醇若插到磷脂的不饱和烃链中间却又可限制了这些含双链烃链的活动性,从而降低了膜的流动性。总之,胆固醇可调节生物膜的流动性至适中的程度。不同生物膜的胆固醇含量不一,细胞膜中含量高,与磷脂的摩尔比可达0.8,线粒体膜中胆固醇含量则甚低。
血浆胆固醇正常人空腹血浆中总胆固醇含量为1.2~2.2g/L(3.1~5.7mmol/L)。血浆胆固醇含量随年龄增长而增高,高脂肪膳食可增高血浆胆固醇;女性在停经后血浆胆固醇增高。胆固醇总量中约2/3为胆固醇酯,胆固醇酯极为疏水,存于脂蛋白核心内,而胆固醇可与磷脂和蛋白质构成脂蛋白与水相接触的表面。血浆中游离的胆固醇可接受卵磷脂上的β位脂酰基而形成胆固醇酯,催化这个反应的酶称卵磷酯胆固醇脂酰基转移酶(LCAT);该酶由肝脏合成,分泌到血浆,而血浆内高密度脂蛋白(HDL)中的载脂蛋白A-I是这个脂酰基转移酶的激动剂,故酯化反应与 HDL密切相关。肝脏合成的胆固醇以极低密度脂蛋白(VLDL)形式送入血浆,在人类VLDL含的主要是游离胆固醇,然后由LCAT转变为胆固醇酯。VLDL经过脂蛋白脂肪酶等作用先后转变为中间密度脂蛋白 (IDL)和低密度脂蛋白(LDL)。LDL所含载脂蛋白B100与组织中的LDL受体结合而被内吞,这是肝脏供应肝外组织胆固醇的方式。当然LDL或VLDL残体也可被肝脏回收。HDL也由肝脏分泌,但它可在血循环中从其他脂蛋白及组织中摄取胆固醇,HDL最后也被肝脏回收,但它起的作用却是从肝外组织携归胆固醇。食物中的胆固醇可直接吸收而胆固醇酯则要经胰液中胆固醇酯酶水解后方可吸收。吸收后的胆固醇以及小肠本身合成的胆固醇在小肠与其他脂肪及一些蛋白质构成乳糜微滴,乳糜微滴运行中经脂蛋白脂肪酶等作用后成为乳糜微滴残体(其原含胆固醇组分损失甚微),与肝细胞载脂蛋白 E受体结合而被吞入;在细胞中胆固醇酯可水解为胆固醇,这是肝脏获取食物中胆固醇的方式,从食物中来的胆固醇可以抑制肝中合成胆固醇;肝外组织从LDL取得的胆固醇也抑制该组织合成胆固醇。
胆固醇的生物合成胆固醇可在人体多种组织中从头合成;即以糖、脂肪酸及氨基酸分解代谢中间产物乙酰辅酶A为原料,经过甚复杂的反应步骤合成胆固醇。肝脏是合成胆固醇的主要脏器,小肠合成的也为数不少。胆固醇的合成有30种以上的酶以及其他一些辅助因子参加,这些酶或存在于胞浆或见于内质网。合成过程大致可分为 5个阶段(图2)。
(1)2分子乙酰辅酶A缩合成为乙酰乙酰辅酶A,再缩合1分子乙酰辅酶 A而成3-羟基-3-甲基戊二酰单酰辅酶 A(HMG-CoA)。HMG-CoA经还原酶催化还原并脱去辅酶A而成为甲羟戊酸(MVA);HMG-CoA还原酶是调节胆固醇合成的关键酶。
(2)6个碳原子的MVA经 2次磷酸化后脱去1个羧基成为5个碳原子的异戊烯焦磷酸(IPP);它可转变成同分异构物3.3-二甲丙烯焦磷酸 (DPP)。
(3)1分子IPP与1分子DPP缩合为10个碳原子的焦磷酸牛儿酯,然后又再缩合1分子IPP而成15个碳原子的焦磷酸法呢酯。两分子焦磷酸法呢酯缩合成30个碳原子的鲨烯。
(4)鲨烯结合到称为固醇载体蛋白 (scp)的胞液成分后受鲨烯环氧酶和环化酶催化而成为环化的羊毛固醇;它已是环戊烷并菲化合物,但却仍含30个碳原子。
(5)羊毛固醇经过约20步酶促反应方转变为27个碳的胆固醇。胆固醇含有很多不对称碳原子,有很多可能的立体异构体,但胆固醇的立体结构是不变的,可见合成反应之精巧准确无误。合成 1摩尔胆固醇需要18摩尔乙酰辅酶A,消耗36摩尔ATP和16摩尔NADPH,要花费很大能量,所以饥饿等状态下胆固醇的合成是降低的。胆固醇的生物合成主要通过 HMG-CoA还原酶实现调节。胆固醇虽无直接抑制该酶的活性,但它或它的氧化物阻遏该酶的合成,食物中的胆固醇进入肝脏或者LDL的胆固醇进入肝外组织也都抑制胆固醇合成。此外,HMG-CoA还原酶还受磷酸化-脱磷酸化机制调节;还原酶由于激酶作用磷酸化后就不具活性,经磷酸酶脱去磷酸根后又可重新恢复活性,这种修饰调节比较快,与一些激素引起的cAMP变化相关。体内胆固醇的合成受一定的控制和调节。胆固醇在体内的量超过正常时,则负反馈抑制 HMG-CoA还原酶。胆固醇反馈抑制的另一个作用点是鲨烯环化为羊毛脂固醇这一步。因此有人认为,食入的胆固醇量较多时,会反馈抑制肝内胆固醇的合成。
胆固醇的排泄胆固醇的固醇核不为人体所降解,但胆固醇可经肝脏从胆汁排入小肠而随粪便排出体外。胆固醇也可在肝脏降解为24个碳原子的胆汁酸,也同样经胆汁排出体外。胆汁酸是含3个或2个羟基的类固醇。在人类胆汁中主要是3个羟基的胆酸(图3)和2个羟基的鹅脱氧胆酸(图4)。
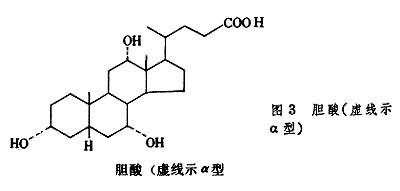
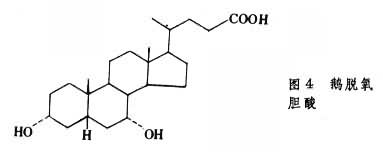
所有的羟基都是α型的,固醇核上有2个β型甲基,这使胆汁酸分子一面具亲水性另一面具疏水性,再加上24位碳上有羧酸,因此两性性质更显著,具很强的乳化脂类的能力。胆酸多以其24位羧基与甘氨酸或牛磺酸的氨基以肽键结合为胆汁酸。胆汁酸既是脂类消化吸收的溶剂,也是胆固醇的排泄形式。 在人类每日可有20~30g胆汁酸分泌到肠中,当消化的脂类在小肠上部被吸收后,胆汁酸也在小肠下部被回收,实际每日只有约0.5g胆汁酸排出体外,其余经门静脉回到肝脏又可再分泌到胆汁中,这就是所谓肠肝循环。有采用阻止胆汁酸重吸收的药物,以增加胆汁酸排出量,从而增加肝脏胆固醇转变为胆汁酸的量,以期降低血浆胆固醇。一般情况,每日排出的1g胆固醇中,约半数以胆汁酸形式排出。未经转变的胆固醇在粪便中被细菌还原为类固醇。
胆固醇与疾病的关系体内胆固醇的来源及去路见图5。正常人体内胆固醇的来源及去路处于动态平衡状态之中,因此正常人血浆胆固醇浓度较稳定,约为110~230mg%。当血胆固醇浓度升高时, LDL浓度也会增高,前者称为高胆固醇血症;后者称为高 LDL血症;它们都与动脉粥样硬化症的发生有关,血中 HDL浓度升高有预防动脉粥样硬化症发生的作用,这是因为 HDL可将动脉壁内膜胆固醇运到肝脏进行代谢,起着清道夫的作用。对高血胆固醇血症除应注意饮食外,可用降血脂药治疗。

