[拼音]:jinshu de yanghua he refushi
[外文]:oxidation and hot corrosion of metals
狭义的金属氧化指金属与氧化合成为氧化物的过程,即 。广义的金属氧化指金属失去电子从而正原子价升高的过程,即Μ=Mn++ne。金属的氧化能否发生,取决于热力学条件(见还原-氧化反应、氧势图)。
。广义的金属氧化指金属失去电子从而正原子价升高的过程,即Μ=Mn++ne。金属的氧化能否发生,取决于热力学条件(见还原-氧化反应、氧势图)。
金属氧化在金属表面生成的覆盖物,称为氧化膜。在金属氧化的初始阶段,膜的增厚与时间常呈线性关系。达一定程度后,膜如果有裂纹,或疏松多孔,则无保护性,金属的氧化继续进行,膜的增厚曲线保持原来的直线形;膜如果比较致密,具有一定的保护性,氧化受到阻滞,膜的增厚曲线转为抛物线形;膜如果非常致密,便具有良好的保护性,氧化基本停止,膜的增厚曲线转为对数曲线形(见图)。在温度升高的情况下,化学反应以及金属和氧通过膜的扩散均将加速,氧化也就会加速。钯、银、汞等金属的氧化物由于热力学上的不稳定,在高温下会分解。环境气氛中含有水蒸气或硫化物时,导致加速氧化,尤以硫化物为严重,常称这种情况为硫化腐蚀。
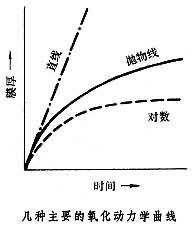
完整的氧化膜才能保护金属,因此,膜的体积(VMO)必须大于氧化消耗掉的金属的体积(VM),这一规律称为皮林-贝德沃斯(Pilling-Bedworth)定律,VMO/VM的比值称为皮林-贝德沃斯比。比值大于1的金属(如Cr、Al、Si、Ti等),氧化膜的增厚曲线为抛物线或对数曲线形;比值小于1的金属(如Ca、Μg、Na、K等),氧化膜的增厚曲线为直线。比值大于 1是能够形成完整而有保护性氧化膜的必要条件而非充分条件。比值远大于1时,膜中存在的应力会导致膜的开裂而失去完整性,也就不能起保护作用。
绝大多数的金属氧化物是非化学计量关系的化合物。有许多是金属离子不足的(点阵中有阳离子空位,如Cu2O,NiO),也有一些是金属离子过剩的(点阵中有间隙金属离子或阴离子空位,如ZnO),前者称为p型,后者称为n 型。膜的点阵中存在缺陷有利于金属和氧通过膜进行扩散,因而有利于氧化的进行。一般说来,当氧的分压增高时,p型的电导率和氧化速度增加,而n型的电导率和氧化速度减小。
合金的氧化目前根据合金的成分还难以定量地推测它的氧化行为。但从热力学观点来看,氧化物的吉氏自由能更负的合金元素会先氧化。
如果在合金中氧的扩散比合金元素的扩散快,则合金中可能生成颗粒状氧化物,这种现象称为内氧化;晶界的氧化也属于内氧化范畴。
如果合金基本元素的氧化物为p型,加入少量原子价较低的合金元素常能阻滞氧化,而加入少量原子价较高的元素常能加速氧化;如这种氧化物为n型,则效果正好相反。这一规律称为豪费(Hauffe)定律。
热腐蚀在高温和熔融的沉积物下,氧和其他腐蚀性气体同时作用,产生的腐蚀称为热腐蚀。例如高温合金在高温含硫和盐的燃气中所发生的腐蚀。在这种情况下,金属腐蚀生成的硫化膜疏松多孔或有裂纹,硫化物的晶体缺陷浓度较大,有利于金属、氧和硫通过膜进行扩散,而且金属硫化物的熔点较低,容易生成熔点更低的金属-金属硫化物共晶 (例如Ni3S2熔点为 787℃,而Ni-Ni3S2共晶熔点只有645℃),基于上述原因,热腐蚀常比单纯的高温氧化严重得多。如果气氛中含有钒、钼等元素,由于V2O3的熔点仅674℃,MoO3在高温下易于挥发,会造成“灾害性”高温腐蚀。
防止措施主要有:
(1)调整合金成分。目的是形成致密氧化膜,提高合金的抗氧化能力。加入的合金元素的皮林-贝德沃斯比值(VMO/VM)应大于1。合金元素的吉氏自由能应较基体金属为负,能先氧化。合金元素应根据豪费定律选择。为了提高抗热腐蚀能力,常加入的合金元素通常为铬、铝、钛和稀土,其中铬和少量稀土的作用已得到公认,对于铝和钛的作用还有争议。
(2)外加保护层。采用渗铝、渗铬、渗硅或铬-铝、铝-硅等多元共渗等化学热处理工艺,使工件的表层合金化;或溅射、熔焊、包镀耐蚀合金,形成耐蚀表面。新发展起来的覆护层Μ-Cr-Al-Y合金对表面保护尤为有效。此外,为提高抗热腐蚀能力也有采用高温陶瓷涂层的。
(3)改变环境介质条件。如采用控制气氛以防止氧化,进行燃料脱盐和脱硫等措施防止热腐蚀。