[中图分类号]Q819[文献标识码]:A
[文章编号]1003-4684(2012)01-0110-04传统的无机盐絮凝剂和有机高分子絮凝剂(如氯化铝、聚丙烯酰胺等)在完成污水处理处置工艺后很容易造成水质的二次污染,对人体都有毒害作用.微生物絮凝剂是一类由微生物产生的可使液体中不易降解的固体悬浮颗粒、菌体细胞以及胶体粒子等凝集、沉淀的特殊高分子代谢产物,主要包含糖蛋白、多糖、蛋白质、纤维素和DNA等.它主要包括利用微生物细胞壁提取物的絮凝剂、利用微生物细胞代谢产物的絮凝剂和直接利用微生物细胞的絮凝剂.作为一种新兴的絮凝剂,它具有安全、高效、可生物降解、不易造成二次污染等优点,因此受到越来越多的关注和重视.目前,微生物絮凝剂的价格较高,主要是由于生产成本高和絮凝剂产率较低的原因.这是因为培养基的组成及培养条件影响微生物絮凝剂产生菌的生理代谢,从而影响微生物絮凝剂的产率.笔者分析絮凝活性的分布以及对培养条件进行优化,旨在提高微生物絮凝剂的产率,为后期的深入研究和实现规模化生产提供依据.
1 材料与方法
1.1 材料
芽孢杆菌(Bacillus sp.)EA,湖北工业大学生物工程学院研究室分离保藏.
种子培养基:葡萄糖,20g/L;酵母膏,5g/L;蛋白胨,10g/L;氯化铵,2.5g/L;磷酸二氢钾,2g/L;硫酸镁,0.4g/L;谷氨酸钠,10g/L.pH 7,115℃灭菌30min.
发酵培养基:葡萄糖,40g/L;谷氨酸钠,30g/L;酵母膏,8g/L;磷酸氢二钾,0.5g/L;MnSO4.H2O,0.1g/L;FeCl3.6H2O,0.05g/L;MgSO4.7H2O,0.5g/L;CaCl2.2H2O,0.15g/L.pH 7,115℃灭菌30min.
1.2 方法
1.2.1 种子培养液的制备 取1环斜面菌种于装有30mL种子培养基的250mL三角瓶中,于28℃、180r/min培养13h得到种子培养液.
1.2.2 发酵培养 按5%接种量将种子液接入发酵培养基(250mL瓶装50mL)于37℃、200r/min震荡培养72h.
1.2.3 絮凝率测定方法 以絮凝率表示絮凝活性,测定方法为:100mL烧杯中加人0.2g高岭土,加50mL蒸馏水、2mL质量分数为1%的CaCl2、1mL发酵液,调pH至7.0.相同条件下不添加任何絮凝剂的水样作为空白对照.采用磁力搅拌器,分两段式搅拌:第一段为以120r/min搅拌2min;第二段为以80r/min搅拌3min,搅拌后静止沉淀5min.使用722型分光光度计在550nm处测定上清液吸光度.絮凝率计算公式如下:
絮凝率=(A-B)/A×100%.
式中:A为对照上清液550nm处的吸光度;B为加样上清液550nm处的吸光度.
1.2.4 絮凝活性的分布 对同样体积的未接种培养液、菌株发酵液(含菌体)、离心去菌体上清液和菌细胞悬液分别进行絮凝活性测定.
2 结果与分析
2.1 絮凝活性的分布
按5%接种量将种子液接入发酵培养基(250mL瓶装50mL)于37℃、200r/min震荡培养72h对菌株进行发酵培养.对未接种的培养液、菌株发酵液(含菌体)、离心去菌体上清液和菌细胞悬液进行絮凝活性测定,相对应的高岭土悬浊液絮凝率分别为0%、71.7%、74.4%、11.3%.
未接种的培养液絮凝率为零,说明液体培养基中不含有絮凝成分物质.菌株发酵液和离心上清液的絮凝率都高达70%以上.含菌体发酵液比离心去菌体上清液絮凝率稍低,可能是菌体较轻,在发酵液中处于悬浮状态,阻碍了光的通过.可知EA菌产生的絮凝物质主要存在于发酵液中,是由微生物在发酵过程中产生并分泌到胞外.
2.2 培养基组成对菌株发酵产物絮凝活性的影响
2.2.1 不同碳源对产物絮凝特性的影响及最佳碳源含量的优化
按照发酵培养基的材料,不加碳源,配置好250mL的无碳源发酵培养基.在培养基的其他成分不变的情况下,更换不同的碳源(各碳源的质量相同),在同样的条件下考察菌株EA的发酵培养液的絮凝率,不同碳源的絮凝率分别为:甘油,61.3%;葡萄糖,73.2%;蔗糖,67.1%;淀粉,72.3%.可见采用葡萄糖和淀粉作为碳源时,产物絮凝率较高.在进行72h发酵培养之后,以葡萄糖作为碳源的发酵液粘性最大,用此发酵液对高岭土悬浊液进行絮凝时形成的絮体比其他样品都大,而且在慢搅过程中絮体就已经沉降,原本浑浊的液体变得澄清.与此相比,其他几种碳源虽也有较为明显的絮凝作用,但形成的絮体较小,沉淀速度较慢.分别测量四种物质作为菌株EA碳源发酵72h后菌细胞悬液的OD值,发现以葡萄糖和淀粉为碳源的明显较大,说明EA菌在含这两种葡萄糖和淀粉的培养基中的数量,明显多于其他两种碳源的培养基.这两种碳源,既有利于菌株EA的生长,又利于絮凝剂的产生.葡萄糖的结构相对简单,可以被直接吸收利用,有利于细胞的代谢和产物的合成,故选取葡萄糖作为发酵培养基的碳源.
2.2.2 不同氮源对产物絮凝特性的影响及最佳氮源含量的优化
按照发酵培养基的材料,不加氮源,配置好250mL的无氮源发酵培养基,在培养基其他成分不变的情况下更换不同的氮源(各氮源的质量相同),考察发酵72h后各个发酵液的絮凝率,其试验结果如下:酵母膏,72.4%;硫酸铵,44.2%;蛋白胨,68.6%;氯化铵,48.5%.可以看出,各氮源对菌株EA所产絮凝剂的影响较大,且酵母膏和蛋白胨等有机氮源的絮凝率明显高于硫酸铵和氯化铵.以酵母膏作为氮源所得到的发酵液絮凝率最高,故选取酵母膏作为发酵培养基的氮源.
2.3 培养条件对菌株发酵产物絮凝活性的影响
2.3.1 pH值的影响
用NaOH溶液分别调节培养基的初始pH值,分别为至5.0、6.0、6.5、7.0、7.5、8.0.测出不同pH值所对应的菌株发酵产物的絮凝率依次为33.2%、52.3%、69.5%、72.9%、75.2%和71.1%.可见菌株EA的最适初始pH值为7.5.培养基初始pH值过高或过低都不利于絮凝剂的产生,这是因为H+和OH-能够影响酶蛋白的氨基解离度和电荷情况,改变酶的结构和功能,引起酶活性的改变.而菌的代谢和絮凝剂的产生都是在酶的作用下发生的生化反应,pH值控制H+和OH-浓度,从而影响菌的代谢和絮凝剂的产生.
2.3.2 温度的影响
调节恒温震荡培养箱的温度,分别设定为28℃、32℃、37℃、40℃.在菌株发酵培养72h后其产物絮凝率分别为49.3%、69.1%、74.6%和73.5%,说明菌株EA在37℃时产物的絮凝效果最好.温度过低,细胞本身的声场受到抑制,酶促反应速度缓慢,影响产物的生成.当温度偏高时,絮凝率下降,因为絮凝剂本身成分是糖蛋白、多糖、蛋白质、DNA等,高温可能导致变性,处理效果受到影响.
2.3.3 不同接种量的影响
在发酵培养基中分别以1%、2%、3%、4%、5%的接种量接入种子液,经摇床培养72h后,分别测定各组发酵液的絮凝活性,实验结果如图1所示.
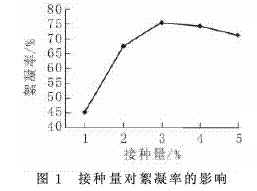
接种量为3%时,絮凝率较高,为75.4%;之后,随着接种量的增大,絮凝率降低.由于接种量过大,培养液中细菌的初始浓度高,生长初期细菌生长繁殖则会消耗大量的营养物质;而接种量过小,培养液中细菌浓度低,使得培养周期延长.
2.3.4 正交设计实验
在单因素实验基础上采用正交实验方法对培养条件进行进一步优化.实验采用L9(34)方法设计正交实验,相对应的三个因素取为接种量、初始pH值和培养温度,每个因素考察3个水平.正交实验的因素水平见表1.
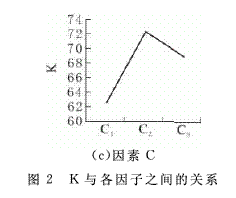
表2中K1、K2、K3分别表示第1、2、3列中水平对应的试验结果之和.为了比较各因素对发酵产物絮凝活性的影响大小,选出各因素中对指标最有利的水平,以各因素的不同水平为横坐标,以各因素对应的K的平均值为纵坐标,作因素和指标关系图.
从图2中可以看出因素B(培养基初始pH值)的三个点高低相差较大,即极差R最大,因此对发酵产物絮凝活性的影响最显著.其次是因素C,影响最小的是因素A,表中最佳培养条件是B3C2A2,即初始pH为7.5,培养温度为37℃,种子液接种量为4%.选取B2C2A1为培养条件,即选择单因子实验时各因素中最优条件进行发酵培养,测其絮凝率为76.6%,小于78.5%.故最佳培养条件为B3C2A2.
3 结论与展望
通过对未接种的培养液、菌株发酵液(含菌体)、离心去菌体上清液和菌细胞悬液进行絮凝活性测定,得出发挥絮凝作用的物质是EA菌的发酵产物,是由微生物在发酵过程中产生并分泌到胞外.通过单因子实验得到最佳碳源是葡萄糖,在以葡萄糖作为碳源时,EA菌的生长旺盛,絮凝率最高.在发酵培养基中有机氮源的效果较好,以酵母膏作为氮源时,絮凝效果最好.通过培养条件单因子实验和正交实验得到的最佳培养条件为:菌株EA发酵培养的最适初始pH7.5,最适培养温度为37℃,最适宜接种量为4%.菌株发酵液的絮凝率也从初始的71.7%提高到78.5%.
在实验室研究阶段培养成本很高,而寻找廉价的秸秆、纤维素等有机物质含量丰富的废水等作为培养底物是推动微生物絮凝剂工业化进程的重要途径.其次,利用分子生物学技术加强絮凝剂产生菌的絮凝基因研究,把控制絮凝剂生成的基因导入到特定的微生物细胞内表达,可以省去筛选的过程并很可能大大提高絮凝剂产率.再次,利用菌株间的相互作用,将絮凝菌同其他污水处理的菌株进行复配,可以拓宽絮凝剂的使用范围,对多种污水进行处理处置.最后,生物化学联合絮凝剂能很大程度上提高絮凝剂的使用效率和处理效果,也将是今后微生物絮凝剂领域一个新的研究方向.














