造纸废水中污染物成分复杂,大多含有苯环结构木素类难降解有机污染物,主要是由三种基本结构单元组成,即愈创木基苯丙烷单元、紫丁香基苯丙烷单元和对羟基苯丙烷单元。当前国内在造纸废水处理方面处于主导地位的仍然是以好氧塘、活性污泥法、生物膜法等为代表的好氧生物处理工艺,以及近十几年发展起来的厌氧生物处理技术。但是制浆造纸工业废水采用单一的生物氧化处理技术存在着难降解的木素类高分子有机物去除不彻底、处理后废水色度仍较高、COD去除率不够理想等不足之处。近年来,光催化技术在制浆造纸工业废水处理上的应用越来越为人们所关注,利用高活性、稳定性的纳米二氧化钛,具有巨大比表面积强力吸收紫外线,可以诱发强氧化自由基.OH,将废水中木素类有机物快速光催化降解,达到深度矿化,实现高效处理。
在现有研究的基础上[4,5],本研究主要以对羟基苯丙酸(简称为HL)作为木素结构的模型物,研究在悬浮体系中纳米TiO2催化剂对对羟基苯丙酸的光降解行为。考察在避光下,对羟基苯丙酸在催化剂TiO2表面上的吸附行为,讨论光源、酸碱度、反应溶液初始浓度、催化剂用量、曝气量等降解单因素对HL光催化降解速率的影响,为今后光催化降解木素的进一步研究提供基础数据。
1.实验部分
1.1木素类模型物对羟基苯丙酸
木素是一种具有各向异性的三维网络空间结构的无定型芳香族化合物,由基本结构苯基丙烷单元(即C6-C3)聚合而成的天然高分子聚合物,主要是由碳、氢、氧三种元素组成。本研究以自制TiO2粉末作为光催化降解反应中的催化剂,以木素的模型物—对羟基苯丙酸(HL)为光催化降解的目标物质,采用紫外-可见分光光度法对对羟基苯丙酸的降解效果进行分析。
对羟基苯丙酸,又名3-(4-羟苯基)丙酸,分子式为C9H10O3,主要包含羧基、酚羟基和双键结构,图1中给出了HL的分子结构式。
通过紫外-可见分光光度计的波谱扫描,确定了HL的最大吸收波长(如图2所示)。
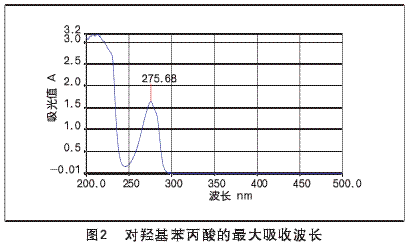
根据图2的实验结果,对羟基苯丙酸在水溶液中具有一个十分明显的特征峰,波长为250.0~300.0nm,选择最大吸收波长λmax=275.68nm,作为测定对羟基苯丙酸在光解过程中的特征波,由此确定该波长下光吸收率与浓度之间的定量关系。
1.2实验仪器、试剂及反应装置
1.2.1的仪器
UV-3000紫外-可见分光光度计(日本岛津);精密电子天平J500型(上海精科天平厂);精密酸度计pHS-3C(天津市盛邦科技有限责任公司);恒温磁力搅拌器79-3型(上海司乐仪器厂);高速离心机UJ3型(德国UPS公司);分光光度计UV-1600型(北京瑞利分析仪器公司制造);紫外杀菌灯ZSZ型(天津市紫晶特种光源有限公司)。
1.2.2的试剂
对羟基苯丙酸(C9H10O3);自制纳米TiO2粉末;氨水(NH3.H2O);碳酸(H2CO3)。
1.2.3的反应装置
光催化反应都是在耐热的双层玻璃反应器中进行,外层为循环冷却水区(外径10cm),内层为反应区(高15cm×内径φ8cm,总体积为750cm3)。实验在敞开的环境中进行(如图3所示),光源采用11W(λ=253.7nm)的紫外杀菌灯,循环冷却水温度控制在20℃。在反应过程中,反应器置于磁力搅拌器上不断进行搅拌,使其悬浮体系分布均匀。

1.3的纳米TiO2光催化降解对羟基苯丙酸
1.3.1的绘制HL溶液的C-A标准曲线在HL的最大吸收波长λmax=275.68nm下以蒸馏水为参比液,用紫外-可见分光光度计测量HL溶液在0~100mg/L浓度范围内的吸光值,将各个浓度下的吸光值与浓度关系绘制C-A标准曲线,如图4。
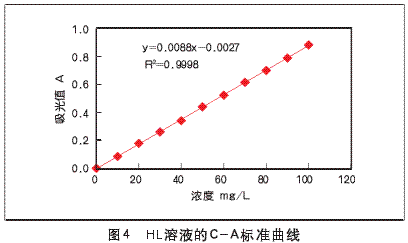
利用一元线性法得到HL溶液浓度与吸光值的关系式
(1):
A=0.0088C-0.0027
(1)
其中,相关系数R2=0.9998。符合Lambert-Beer定律,即光的吸收定律。
1.3.2的HL在催化剂表面的吸附实验
通过HL在催化剂表面上的吸附行为,确定吸附在HL的光催化降解过程中的作用,为了避免光催化降解,吸附实验在暗室内进行。具体操作:称取400mg/L的TiO2光催化剂,量取500ml浓度分别为40.00mg/L、60.00mg/L、80.00mg/L的HL溶液置于反应器中分别进行反应,每隔10min取水样,离心处理,取上层清液进行吸光值测定,分析溶液浓度变化,直到浓度不再变化,即达到吸附和脱附平衡。1.3.3的光催化降解实验在室温下,取一定浓度HL溶液溶于500ml去离子水中,配置成反应混合液于反应器中,投加一定量的TiO2,避光下经磁力搅拌达到吸附平衡后,打开紫外灯对其进行光照实验。每经过一段时间,取经不同光降解反应时间后的反应液5ml,经30min的高速(8000r/min)离心分离催化剂,采用医用针筒从离心管的中心取其上清液,避免颗粒物对测定的干扰,测定其在275.68nm处的吸光值,通过C-A的关系式
(1)换算出反应后HL的剩余浓度,进而得到其降解率。2的结果与讨论2.1光源对HL降解的影响光催化反应过程中,紫外光和催化剂对于降解结果有着至关重要的作用,因此本实验设有三组对比实验,分别为:没有紫外光源有TiO2;有光源无TiO2;光源、TiO2共同存在。结果如图5,表明在光源照射和催化剂同时存在的条件下,光催化反应才会发生。
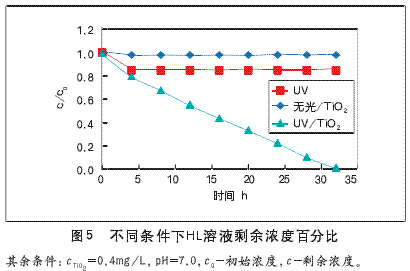
单独紫外光照射或只有催化剂的条件下,HL溶液浓度都只有很微小的减少并且在短时间内就不再减少。原因:在有紫外光照、无TiO2存在下,HL溶液的剩余浓度微量减少了2%左右,主要由于紫外光照射生成了臭氧,臭氧对有机物的部分降解作用;而无光源、有TiO2条件下,HL溶液的剩余浓度减少了15%左右,主要是由于HL在TiO2表面上吸附的结果;而在光源和TiO2同时存在下经32h后,HL溶液剩余浓度出现了很大的改变,减少了90%左右,并随着反应时间的延长,浓度的残余量快速减少,这就表明在光催化剂和紫外光照射共同作用下才会产生降解作用。
2.2吸附实验
通过实验得到,无光照下TiO2催化剂对HL的吸附在60min内就达到吸附平衡,实验结果见图6。
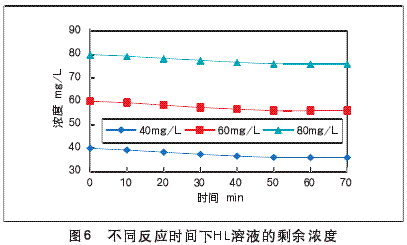
根据实验结果可以看出,初始浓度分别为40mg/L、60mg/L、80mg/L的HL溶液,随着吸附实验的进行,浓度逐渐变小。这三种不同初始浓度的溶液到60min后浓度均不再变化,故认为无光照下TiO2催化剂对HL的吸附在60min内就达到吸附平衡。
2.3光照时间对HL降解的影响
在固定其他条件下,考察不同光照时间对HL降解率的影响。实验的具体操作:pH=7.0,催化剂用量为400mg/L,c0=70.00mg/L的HL溶液500ml,在反应装置(如图3)内进行光催化降解反应,每隔2h取反应液,离心处理后在λmax=275.68nm处,测定上清液的吸光值,结果如图7所示。
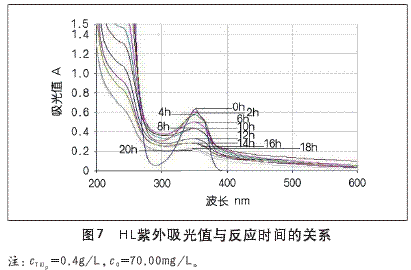
由图7可以看出,浓度为70.00mg/L的原水在20h的降解过程中,在波长为275.68nm处的峰高有明显的降低,同时没有其它波长的峰高出现。而在光照2h和20h后,HL的降解率分别达11%和65%以上,说明随着光照反应时间的增加,HL的降解率随之增加。
2.4溶液初始浓度对降解的影响
考虑到溶液的初始浓度也是影响光催化能力的重要因素之一,本实验单一变换HL溶液初始浓度来考察初始浓度对光催化降解HL的影响。反应装置(如图3)在紫外光照下,溶液pH=7.0,催化剂的用量为400mg/L,对初始浓度为40.00mg/L、60.00mg/L、80.00mg/L、100.00mg/L的HL溶液各500ml,分别进行光催化降解反应,结果如图8所示。
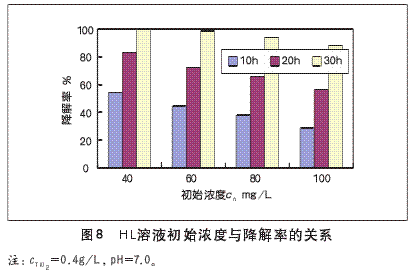
图8说明随着HL初始浓度的增加,在相同的处理时间内降解率下降;或随着HL初始浓度的增加,要达到相同的降解率,就需要更长的反应时间。原因在于:
(1)溶液的浊度增加,透光率相应降低,光催化剂受光面积减小,而导致参与光催化氧化反应的光子数量减少。
(2)在光强和催化剂不变的条件下,相同时间内产生的光生电子(e-)和空穴(h+)的数目是相同的,HL浓度越大降解率就相对降低。
2.5催化剂用量对降解的影响
我们在讨论光催化降解HL时,考虑对应处理不同浓度的HL溶液,TiO2光催化剂存在一个最优投加量。具体实验条件:对c0为60.00mg/L和80.00mg/L的HL溶液各500ml,pH=7.0,进行光照20h,光催化剂TiO2的用量范围从0到800mg/L,在反应装置(如图3)中分别进行反应,结果如图9。
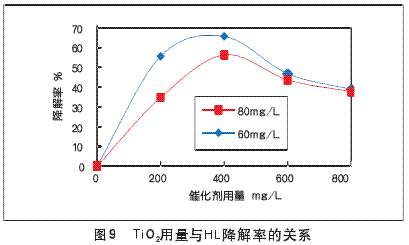
由图9可知,对于c0=60.00mg/L和80.00mg/L的两组溶液,当TiO2用量分别为400mg/L时,其两组降解率最高分别为65.74%和56.34%。当TiO2用量减小或增大,两组溶液降解率都下降。原因是:当TiO2用量增加时,光生电子(e-)和空穴(h+)数目也相应增加,光催化氧化速率加快;而当TiO2用量达到一定值后:
(1)由于颗粒浓度增大溶液的浊度增加,从而对光照起遮蔽作用,影响反应体系对光的充分吸收。
(2)TiO2容易发生团聚,发挥不出比表面积大的优势,导致光催化氧化速率下降。因此可认为一定初始浓度的HL溶液存在最优的TiO2投加量。
2.6溶液pH对光催化降解的影响
二氧化钛催化剂对不同有机物的降解存在不同的最佳pH值,最佳pH值因不同物质的结构而异,并且pH值的变化趋势对不同降解物的影响趋势也不一样。
用碳酸和氨水调节c0=60.00mg/L和80.00mg/L的HL反应液的pH值,pH值与降解率的关系如图10所示。
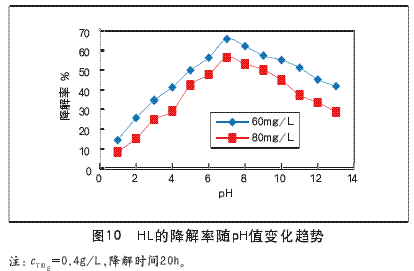
由图可知,不同初始浓度的HL溶液两条降解曲线变化趋势一致。在降解进行20h时,取其中c0=60.00mg/L的HL溶液:在pH=1.0~7.0时,随着pH值增加,HL的降解率快速增大,在7.0时达到最大65.74%;pH值为7.0~13.0时,HL的降解率降低;原因:HL的降解率与TiO2的表面电性、HL分子溶液极性、TiO2表面的吸附量、羟基自由基的浓度有关,而这些因素都与溶液pH值有关。
(1)改变pH值将改变溶液中界面电荷性质,改变TiO2颗粒表面所带电荷,从而改变其在溶液中的分散性。当pH值接近TiO2粒子等电点(pH=6)时,由于范德华引力的作用,颗粒之间易团聚形成大颗粒;当悬浮液pH值远离TiO2等电点时,由于颗粒间相互排斥,其在溶液中分散性好,此时TiO2光催化活性高。
(2)pH值的改变影响TiO2表面上的吸附行为,影响光生电子—空穴向TiO2表面的迁移。TiO2是一种两性金属氧化物,通常在水中的等电点约为pH=6.0,当pH>6.0时,TiO2表面带负电荷,反之,TiO2表面带正电荷,而pH=6.0左右时显中性。
(3)在低pH值时,由于[H+]的适当增加,TiO2表面.OH自由基浓度增加,所以在pH=1~7时降解率增加。在弱碱下,HL更易解离生成H+和C9H9O32-,C9H9O32-的量增大提高了与催化剂表面活性位置的接触机率;而在高pH下,含OH-的TiO2表面带负电荷,使得光生电子的脱出功增加,不利于e-到达表面,同时会捕获H+,不利于有机物的降解,因此在pH增大时HL的降解率降低。
本实验中,起始pH=7时光催化降解HL的效果较好。
2.7曝气量对降解的影响
选用曝气的方式作为外加氧化剂,促进有机物的光催化降解。实验中,初始浓度为60mg/L的HL溶液,当光降解至20h时,曝气量与降解率的关系如图11。
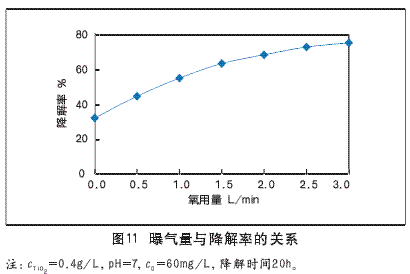
在相同的反应时间下,HL的降解率由无曝气下的32.45%到曝气量为3.0L/min下的75.79%,说明增加曝气量可以提高降解率。原因是:曝气量增加了体系中的溶解氧,在紫外光的照射下,被激发生成氧化性较强的臭氧氧化剂;O2作为电子接受体,减低电子与空穴的复合;TiO2表面吸附O2-和O2捕获e-,生成活泼的O22-、HOO-、H2O2和O-O键活性氧化物种。当反应体系中加入外加氧化剂O2、H2O2、O3等良好的电子捕获剂,催化剂表面的电子被氧化剂捕获,能不同程度地提高电子-空穴对的分离,降低了空穴与电子复合几率,从而增加了光降解能力。
3.结论
使用自制的TiO2光催化剂,在自行设计的光催化剂的反应中,对构成木素主要组成部分的对羟基苯丙酸进行了光催化降解实验,得出如下结论:
3.1无光下,TiO2催化剂对HL的吸附在60min内达到吸附解吸平衡,不同初始浓度HL在催化剂表面吸附总量百分比基本相同,经计算TiO2表面饱和吸附量为起始浓度的7.1%;只有在TiO2与紫外光照射共同作用下,HL才可发生由有机大分子到小分子的逐步光催化降解,最终达到完全矿化。
3.2根据降解吸光值曲线,对于初始浓度为60.00mg/L的HL溶液,经紫外催化降解20h,去除率达到65.74%,光照至34h,可以完全矿化。
3.3降解单因素:HL溶液初始浓度越高,降解率越小;一定初始浓度的HL溶液存在最优的TiO2用量范围,本实验中选择催化剂的最适用量为400mg/L;采用自制TiO2降解HL溶液的最优pH值为7.0左右;曝气量的增大对HL降解速率有促进作用。













